CONCOURS COMMUN 2004
DES ÉCOLES DES MINES D'ALBI, ALÈS, DOUAI, NANTES
Épreuve Spécifique de Physique et Chimie
(filière PCSI option PC) \
Mercredi 19 mai 2004 de 08h00 à 12h00
Barème indicatif: Chimie 1/2 - Physique 1/2
Instructions générales :
Les candidats doivent vérifier que le sujet comprend : 12 pages numérotées
1/12, 2/12, ...12/12
Les candidats sont invités à porter une attention particulière à la rédaction :
les copies illisibles ou
mal présentées seront pénalisées.
Les candidats colleront sur leur première feuille de composition l'étiquette à
code à barres
correspondante.
L'emploi de la calculatrice est interdit
Feuilles jointes : papier millimètré semi-logarithmique (Physique)
papier millimètré arithmétique(Chimie)
PHYSI UE
En physique, il est très souvent intéressant de caractériser un système par un
paramètre sans
dimension, qui ne dépend que de la constitution du système.
Les deux premières parties, totalement indépendantes, traitent du facteur de
qualité Q, l'une en
électrocinétique, l'autre en mécanique. Après introduction du paramètre dans
les équations, c'est
l'interprétation énergétique de Q qui est favorisée.
La troisième partie, indépendante des autres, traite du grossissement G d'un
système optique, la
lunette astronomique.
PARTIE 1: LE FACTEUR DE UALITE EN ELECTROCINETI UE: ETUDE D'UN
FILTRE PASSIF.
On étudie le circuit linéaire ci-- d--essous.
Il est composé de trois dipôles en série: une résistance R, une inductance
parfaite de coefficient
d'induction L, et d'un condensateur de capacité C.
' (((.
e (t) s(t)
C
Il est soumis à une tension d'entrée sinusoïdale e(t) : Em cos(wt + ça). On
note s(t) la tension de
sortie.
En notation complexe, on notera, pour e(t) par exemple, e=EmeJW' =E e"'e"" avec
Em ,
m
l'amplitude complexe.
1. A l'aide de deux schémas équivalents du circuit, l'un en hautes fréquences,
l'autre en basses
fréquences, donner la nature de ce filtre.
2. Fonction de transfert
a. Etablir la fonction de transfert de ce filtre sous la forme :
L
1 avecwo= 1 etQ= W°= 1
JLC R RCwO
aow>= 1 W
1+j----+(j--)2
QW0 WO
Donner l'ordre de ce filtre.
b. Si e(t) est une foncti0n quelconque du temps (non sinusoïdale), quelle est
l'équation
différentielle entre les fonctions s(t) et e(t) ?
Pour quelle raison peut-on affirmer la convergence du régime transitoire ?
3. Exprimer le module de la fonction de transfert _ , en fonction de w, wo et Q.
. 1
4. Montrer que |_H_ ( jw)| passe par un max1mum pour Q>--. Comment appelle-t-on
ce
&
phénomène ? Déterminer, wr , la pulsation correspondant à ce phénomène, en
fonction de
WO et Q.
5. On appelle gain, la fonction GdB , telle que G dB = ZOloglfi ( jw)l .
Donner les équations des asymptotes de G dB aux basses fréquences et aux hautes
fréquences.
Exprimer G dB (w = WO ) .
6. Tracer l'allure du diagramme de Bode en gain pour Q =... et Q=--l-- sur la
feuille de
10
papier semi-logarithmique fournie.
IH (jW) max
&
Justifier que la bande passante est alors définie à -3dB et placez-la sur les
graphes.
On définit les pulsations de coupures (wc) d'un filtre par la relation :|H (
jwc) < 7. Interprétation énergétique du facteur de qualité Q. On suppose Q >> 1 .
a. Montrer que si w = WO , alors i(t) : [max cos(wot) .
b. Déterminer alors uc (t) , la tension aux bornes du condensateur en fonction
de C, wo
et I... .
c. On note AW , l'énergie dissipée par effet J oule dans la résistance sur une
période.
7ZR12
Montrer que AW = ""'" .
, , WO
d. On note Wm , l'énergie maximale reçue par le condensateur.
Montrer que Wm = I'... .
2wa
e En déduire ue Q -- 27z W'""'
. q --- AW .
FIN DE LA PARTIE 1
PARTIE 2: LE FACTEUR DE UALITE EN
OSCILLATEUR HARMOng QUE AMORTI
MECANI UE : ETUDE D'UN
On considère le dispositif mécanique suivant, placé dans le référentiel du
laboratoire 9% , supposé
galiléen.
Il est composé d'une bille M, supposée ponctuelle, de masse m qui glisse sans
frottement sur un axe
horizontal. Elle est reliée : '
o à un ressort de raideur k et de longueur à vide [0 , maintenu fixé à une de
ses extrémités à un
mur vertical. .
o à un dispositif «amortisseur » fixé au même mur, qui soumet la bille à une
force de
frottement de type fluide ? = --hÎ) .
k,lo
0° 1
«: .
N.l
_)
f=--hü
On note O, la position de la bille quand le ressort est à sa longueur à vide,
et en prenant O comme
origine, on repère la position de M par x = OM .
1. Faire un bilan des forces et justifier très brièvement que le système n'est
pas conservatif.
En appliquant le théorème de l'énergie cinétique à la bille, montrer que la
variation de
l'énergie mécanique s'écrit sous la forme dE m = --hv'dt .
2. Appliquer le Principe Fondamental de la Dynamique à la bille dans ER , et
montrer que
.. W . k mw
x+--â--x+wfix=0 avec WO=,/-- etQ= h°.
- m
3. On se place dans le cas du régime pseudo--périodique. Les solutions sont de
la forme
Wo
------t
x(t) = e 2Q A cos(wt + ça) avec A et (p des constantes, et w = wo l-- 4le .
a. Donner la condition sur Q pour être dans un tel régime.
Tracer l'allure de x(t).
b. On se place dans le cas de l'amortissement faible Q >> 1. Exprimer
AT T_To
T0 T0
en fonction de Q et en déduire que w = WO .
Rappel : Développement limité à l'ordre 1 en u : (l + u)" = l + au
4.__ Interprétation énergétique de Q
Dans toute la suite, nous supposerons que w = w() .
a. Justifier que l'énergie potentielle de M peut s'écrire Ep(t) = %kx'(t) ,
puis expliciter
Ep(t)-
b. Expliciter Ec(t) , l'énergie cinétique de M en fonction du temps.
c. Montrer que l'énergie mécanique Em(t) est de la forme Em(t) =Kle--KZ' où l'on
exprimera K1 en fonction de A et k , et K 2 en fonction de WO et Q.
d. On définit la variation d'énergie mécanique par AEm (t) = 'Em (t + T) -- E m
(t)] .
E !
Montrer que Q=272' m() .
AE...(t)
FIN DE LA PARTIE II
PARTIE 3: LE GROSSISSEMENT EN OPTI UE : ETUDE D'UNE LUNETTE
' ASTRONOMIQUE
On considère une lunette astronomique formée :
0 d'un objectif constitué d'une lentille mince convergente L1 de distance focale
f,'=O,F'1 >O.
. d'un oculaire constitué d'une lentille mince convergente L2 de distance focale
f,_'= O,F'2 >O.
Ces deux lentilles ont même axe optique A .,
On rappelle qu'un oeil normal voit un objet sans accommoder quand celui-ci est
placé à l'infini.
On souhaite observer la planète Mars, qui est vue à l'oeil nu sous un diamètre
apparent a .
l. Pour voir la planète nette à travers la lunette, on forme un système afocal.
a. Que cela signifie-t-il ? Que cela implique-t--il pour les positions des
lentilles ?
b. Faire le schéma de la lunette en prenant f'] = 5 f '2 .
Dessiner sur ce schéma la marche à travers la lunette d'un faisceau lumineux
formé
de rayons issus de l'étoile. On appellera A'B' , l'image intermédiaire.
0. On souhaite photographier cette planète. Où faut-il placer la pellicule ?
2. On note a' , l'angle que forment les rayons émergents extrêmes en sortie de
la lunette. .
a. L'image est--elle droite ou renversée ?
, . , . a . '.
b. La lunette est caractensee par son gross1ssement G = --. Exprimer G en
fonct10n
a
de f '1 et f '2.
c. Le principal défaut d'une lentille est appelé défaut d'aberrations
chromatiques:
expliquer brièvement l'origine de ce défaut et ses conséquences. Pour quelle
raison
un miroir n'a-t-il pas ce défaut ?
3. On veut augmenter le grossissement de cette lunette et redresser l'image.
Pour cela, on
interpose entre L1 et L2 , une lentille convergente L3 de distance focale f '3
= O3F'3 >O. -
L'oculaire L2 est déplacé pour avoir de la planète une image nette à' l'infini
à travers le
nouvel ensemble optique.
Quel couple de points doit conjuguer L3 pour qu'il en soit ainsi '?
b. On appelle 73, le grandissement de la lentille 3. En déduire O3F'1 en
fonction de
f'3 et 73°
c. Faire un schéma.} (On placera 03 entre F '1 et F2, et on appellera A'B'
lapremière
image intermédiaire et A"B' ' , la Seconde image intermédiaire).
d. En déduire le nouveau grossissement G' en fonction de 2/3 et G . Comparer à
G , en
norme et en signe.
FIN DE LA PARTIE III
CHIMIE
Première partie : Etude cinétique de l'addition de diiode sur un alcène
On étudie la cinétique de la réaction d'addition du diiode sur un alcène
suivant le schéma général suivant :
1 3 R1 R3
R R | |
\C=C/ + 12 --> l--C--C--l
2' \ 4 |2 |4
R R R R
Le but de l'étude est de déterminer l'influence de la nature de l'alcène et du
solvant sur l'ordre partiel de la
réaction par rapport au diiode, sur la constante k de la réaction et sur le
temps de demi-réaction t....
Le principe de la manipulation est le suivant :
- A la date t = 0, du diiode 12 est mis à réagir sur l'un des alcènes étudiés
dans un solvant donné.
- A des dates t successives, on effectue des prélèvements du milieu réactionnel
que l'on dose par une solution
aqueuse de thiosulfate de sodium Na28203 afin de déterminer la quantité de
diiode n'ayant pas encore réagi.
-- L'allure de différentes courbes faisant intervenir des fonctions de [12] et
t permet de déterminer l'ordre de la
réaction, sa constante de vitesse k et le temps de demi-réaction t1/2 pour un
couple alcène--solvant donné.
1 Etude cinéti ne de la réaction d'addition de diiode sur un alcène
Le protocole opératoire utilisé pour chaque couple solvant--alcène est le
suivant :
(1) Mise en route de la réaction d'addition
A la date t = 0, sont mis en présence dans un erlenmeyer de 250 mL, 50 mL d'une
solution à 0,6 mol.L'1
d'alcène dans le solvant d'étude et 50 mL de solution à 0,04 mol.L'1 de diiode
12 dans le solvant d'étude. On
laisse la réaction se faire, sous agitation, à la température constante de 25
°C.
(2) Dosages réalisés à différentes dates t :
A 25 mL d'une solution aqueuse de iodure de potassium K+,I' à 0,12 mol.L", on
ajoute vo = 5 mL de solution
prélevée depuis le milieu réactionnel. La date t est relevée au moment où la
pipette de 5 mL contenant le
prélèvement est à moitié vidée. La solution ainsi préparée est immédiatement
titrée par une solution aqueuse
de thiosulfate de sodium Na28203 à c = 0,01 mol.L'l. A l'équivalence du dosage
la coloration jaune de la
solution titrée disparaît. Le volume correspondant à l'équivalence du dosage
est relevé.
A) Etude théorique de la loi de vitesse suivant que la réaction est d'ordre
partiel 1, 2 ou 3 par raggort au
diiode Iz
I.A.l.a) Donner la définition de la vitesse volumique v de réaction en
utilisant les concentrations de chacun
des réactifs.-
I.A.l.b) Donner l'expression de la vitesse de réaction, sachant que la réaction
admet un ordre partiel n par
rapport au diiode 12 et un ordre partiel p par rapport à l'alcène. Que vaut
l'ordre global ?
I.A.l.c) Montrer que, dans le milieu réactionnel, l'alcène est introduit en
large excès par rapport au diiode.
Montrer que l'expression de la vitesse de réaction peut alors se mettre sous
une forme simplifiée, faisant
apparaître une constante de vitesse apparente, que l'on notera kapp. De quelle
technique de détermination
d'un ordre s'agit-il ici ?
I.A.2.a) Dans l'hypothèse d'une réaction d'ordre partiel n = 1 par rapport au
diiode, donner l'expression
donnant l'évolution de la concentration en diiode au cours du temps t, en
fonction de [h]... concentration
initiale en diiode dans le milieu réactionnel, kapp et t.
Quelle fonction de la variable [12] faut--il représenter en fonction de t pour
obtenir comme représentation
graphique une droite si la réaction est bien d'ordre 1 par rapport à 12 '?
I.A.2.b) Dans l'hypothèse d'une réaction d'ordre partiel n = 2 par rapport au
diiode, donner l'expression
donnant l'évolution de la concentration en diiode au cours du temps t, en
fonction de [b]... concentration
initiale en diiode dans le milieu réactionnel, kapp et t.
Quelle fonction de la variable [12] faut-il représenter en fonction de t pour
obtenir comme représentation
graphique une droite si la réaction est bien d'ordre 2 par rapport à 12 '?
I.A.2.c) Dans l'hypothèse d'une réaction d'ordre partiel n = 3 par rapport au
diiode, donner l'expression
donnant l'évolution de la concentration en diiode au cours du temps t, en
fonction de [b]... concentration
initiale en diiode dans le milieu réactionnel, kapp et t.
Quelle fonction de la variable [12] faut--il représenter en fonction de t pour
obtenir comme représentation
graphique une droite si la réaction est bien d'ordre 3 par rapport à 12 '?
BZ Dosage du diiode restant gar le thiosulfate de sodium
Les solvants utilisés ici sont non miscibles à l'eau.
I.B.l.a) La solubilité du diiode 12 dans l'eau est assez faible, elle est bien
plus importante dans les solvants
organiques utilisés ici. Comment expliquer la faible solubilité du diiode dans
l'eau '? Quelle est la nature
précise des interactions existant entre les molécules d'eau et une molécule de
diiode dissoute, entre
molécules d'eau, entre molécules de diiode '? Dans quelle phase se trouvent la
majorité des molécules de
diiode lorsqu'on est en présence d'un mélange non miscible solvant
organique-eau '?
I.B.l.b) On accroît fortement la solubilité de 12 dans l'eau en ajoutant de
l'iodure de potassium KI en raison
de l'existence d'un équilibre de complexation :
12 + I' : 13° de constante Kf = 102'9
Déduire de ces informations, l'intérêt d'ajouter 25 mL d'une solution d'iodure
de potassium au prélèvement
avant de réaliser le titrage par une solution aqueuse de thiosulfate de sodium.
I.B.2) La date t, à laquelle on dose la concentration en diiode restant
est--elle précise ? Pourquoi faut-il
réaliser le titrage le plus rapidement possible ? Montrer que l'ajout de 25 mL
d'une solution d'iodure de
* potassium à 5 mL de milieu réactionnel permet, en plus de l'intérêt mentionné
à la question précédente,
d'améliorer la précision sur la date t. Que peut--on proposer d'autre pour
améliorer la précision sur cette
date t ?
Lors du dosage du diiode restant par le thiosulfate de sodium Na28203, les
couples mis en jeu sont I3'/I' et
s4OÔZ'/szof:
I.B.3.a) Déterminer le degré d'oxydation du soufre S dans l'ion thiosulfate
820321
I.B.3.b) Ecrire l'équation bilan de la réaction de dosage.
I.B.3.c) Etablir l'expression du potentiel d'oxydoréduction standard du couple
I3'/I' à 25°C en fonction du
potentiel d'oxydoréduction standard du couple 12/1' et de la constante de
formation Kf de l'ion lg,". En déduire
la valeur numérique du potentiel d'oxydoréduction standard du couple I3'/I' à
25°C.
I.B.3.d) Etablir l'expression de la constante de la réaction de dosage K" en
fonction des potentiels
d'oxydoréduction standard adéquats. En déduire l'ordre de grandeur de sa valeur
numérique. Cette réaction
est-elle quantitative ? Commenter.
I._B.3.e) Etablir la relation existant entre la c0ncentration en diiode restant
dans le milieu réactionnel à
l'instant t et. le volume qu de solution de thiosulfate de sodium versé à
l'équivalence.
C Détermination de l'ordre artiel ar ra ort au diiode de la réaCtion d'addition
de diiode sur le
cyclohexène en solution dans le 1,2--dichloroéthane
Le tableau 1 (ci--dessous) indique les volumes équivalents relevés à
différentes dates t pour la réaction
d'addition de diiode sur le cyclohexène en solution dans
lel,2--Jdichloroéthane. '
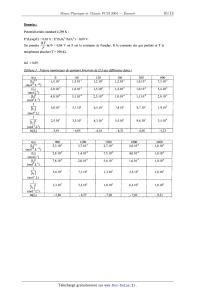
Tableau 1 : Volumes e' uivalents relevés lors du titra e du diiode restant & di
érenæs dates t our la réaction
d'addition de diiode sur le cyclohexène en solution dans le 1,2-dichloroéthane '
A partir des résultats expérimentaux, les courbes représentatives de
--[-------- = f(t) et de = f(t) ont été
12] [12l2
tracées (v0ir figure 1). ' '
F igùre ] :
Représentation graphique de ÎÏ1_] = f(t)
, ' 2
_L >< 10'3 1[12l , ftnol*lë 0 500 1000 1500 2000 2500* 0 \ 500 1000, 1500 2000 temps(s) ' ' _ ' temps(s) 2500 ?" LG. 1) Peut--on déterminer, de manière certaine, l'ordre partiel par rapport au diiode de la réaction d'addition de diiode sur le cyclohexène en solution dansle l,2--dichloroéthane à l'aide des courbes de la figure 1 '? \- - I.C.2) En utilisant les données expérimentales du tableau 1 et les valeurs numériques du tableau 3, tracer sur la feuille de papier millimétré fournie, la courbe permettant de valider l'hypothèse du dernier ordre partiel. Conclure quant à l'ordre partiel par rapport au diiode de la réaction d'addition de diiode sur le cyclohexène en solution dans le 1,2-dichloroéthane. ' I.C.3) Déduire de la courbe tracée l'ordre de grandeur de la valeur numérique de la constante de vitesse apparente kapp de la réaction à 25°C. I.C.4) Rappeler la définition du temps de demi--réaction t1/2. Déterminer l'ordre de grandeur de sa valeur numérique pour la réaction d'addition de diiode sur le cyclohexène en solution dans le l,2--dichloroéthane à 25 °C. II Etude du mécanisme de la réaction d'addition de diiode sur un alcène Le mécanisme mis en jeu lors de l'addition de diiode 12 sur le cyclohexène dans le l,2-dichloroéthane est semblable à celui d'une dibromation d'un alcène dans un solvant dispersant. Il.l.a) Par analogie avec l'action du dibrome sur un alcène, écrire le mécanisme de l'action de 12 sur le cyclohexène. Préciser l'étape cifiétiquement déterminante. II. 1 .b) En appliquant la loi de Van't Hoff à l'étape cinétiquement déterminante, montrer que l'on retrouve la conclusion annoncée à la question concernant l'ordre partiel de la réaction par rapport à 12. Quel est l'ordre partiel de la réaction par rapport à l'alcène ? Il.l.c) Tracer le profil réactionnel associé à ce mécanisme. Il.l.d) Donner le nom et la stéréochimie du (ou des) produit(s) obtenu(s) par action du diiode sur le cyclohexène. Le produit obtenu est-il optiquement actif '? Il.l.e) La réaction est--elle stéréosélective, stéréospécifique '? Justifier. Il.l.f) Représenter le(s) produit(s) dans sa(leur) conformation la plus stable. Justifier. On étudie désormais l'influence du degré de substitution de l'alcène et du solvant sur l'ordre et le temps de demi-réaction. Le tableau 2 (ci-dessous) regroupe les résultats obtenus pour différents couples alcène-solvant à 25 °C. Tableau 2 : Résultats cinétiques obtenus à 25°C pour di[Ïérents couples alcène - solvant ___-- II.2.a) Le solvant a--t-il une influence sur l'ordre partiel de la réaction par rapport au diiode ? Que peut--on en déduire quant au mécanisme de la réaction dans ces deux solvants différents ? Il.2.b) Quelle est l'influence du degré de substitution de l'alcène sur la vitesse de réaction ? Proposer une explication permettant d'interpréter les résultats expérimentaux. 4 Données : Potentiels rédox standard à 298 K : E°(Maq)/I')-- -- 0,62 V ; E°(S4062782032') = 0,09 v. ' R .T On prendra ----ln10-- -- 0,06 V où F est la constante de Faraday, R la constante des gaz parfaits et T la F température absolue (T = 298 K). ln2 : 0,69. Tableau 3 : Valeurs numériques de quelques fonctions de [122 aux différentes dates t W..." [12]12 1,410"1 1,"3.101 1,210"1 1,210"1 1,.010"1 7,310"2 rn11-/2Ll/2 2,.010"2 1,."8102 1,."5102 1,4102 1,.010 5,."4103 mol.L1 [12] 4,."0104 3,1104 2,3."104 1,8."104 1,.110"4 2,.9105 molz.L2 3,3.1OE 4,31OE 5,5.1OE 9,4.1OE 3,5.1OE Le linalol est un composé utilisé en parfumerie en remplacement de l'huile essentielle de lavande en raison de son odeur voisine. On propose d'étudier ici une synthèse possible de cette molécule, selon la séquence 'réactionnelle suivante. /U\ --------> ----------> ><)H/ ___--> C (majoritaire) + C'
ROOR '
H+
C ----------> D (majoritaire) + D'
chauffage
0
Il
/C\ +
Mg H H H30 soc12
D ------> E ------------> F --------> G ___--> H
Et2O -HCl, - 802
Mg / H3 O+
linalol
1) Donner le nom du linalol en nomenclature officielle.
2) Donner la formule topologique des produits C, C', D, D', E, F, G, H, I et J.
3.a) Ecrire le mécanisme de la réaction B --> C + C'. Justifier l'orientation
observée.
3.b) Qu'aurait--on obtenu comme produits en réalisant cette étape en l'absence
de peroxyde '? Quel aurait été
le produit majoritairement formé '? Justifier.
4.a) Ecrire le mécanisme de l'étape C --> D + D'. Justifier l'orientation
observée.
4.b) Quel(s) produit(s) aurait-on obtenu(s) en procédant au chauffage de C en
milieu basique ?
5 Ra eler les conditions 0 ératoires de la ré aration d'un or anoma nésien
verrerie nécessaire
)
précautmns nécessa1res à l'obtention d'un bon rendement). Fa1re un schéma du
montage expénmental ut1lrsé.
Quel est le rôle joué par l'éther diéthylique Et20 lors des étapes D ---> E et
H ----> I ?
6) Dans l'étape G --> H, on a utilisé comme réactif, l'agent chlorurant
chlorure de thionyle SOC12 qui permet
d'obtenir H avec un très bon rendement.
Quel autre agent chlorurant aurait-on pu utiliser à la place du chlorure de
thionyle pour obtenir H '?
7) Ecrire le mécanisme de l'étape 1 _) J. Cette étape est--elle
stéréosélective, stéréospécifique ? Le produit
obtenu est--il optiquement actif ? Préciser.
8) Le géraniol est une molécule présente dans l'essence de géranium. On peut
synthétiser en une étape le
géraniol à partir du linalol en traitant le linalol en milieu acide (H")
OH
linalol géraniol
Proposer un mécanisme permettant d'expliquer l'isome'risation du linalol en
géraniol. Indiquer pourquoi
cette isomérisation est thermodynamiquement possible alors qu'il est
thermodynamiquement impossible de
réaliser la transformation inverse avec un rendement acceptable.
9.a) Rappeler les réactifs nécessaires pour réaliser une ozonolyse, suivie
d'une hydrolyse en milieu
réducteur.
f9.b) On admet que la fonction alcool n'est globalement pas modifiée lors d'une
ozonolyse suivie d'une
hydrolyse en milieu réducteur.
Montrer, que l'analyse des différents produits obtenus (dont on donnera la
formule) lors d'une ozonolyse,
suivie d'une hydrolyse en milieu réducteur, perrriettrait de distinguer le
linalol et le géraniol.
FIN DE L'EPREUVE
(..
......
. w
+.....t.
.. ...... ......
.....
..k.J..J ....
>...\..:.
.\..\.A.A
;..ç...
..--.
..;..J,.<.... --« .-...--...a.;..;.. ..\.J..f..q...4...z.. .4.., .._.. + .. _ (... .... ,+_,_, il...... .... ...»...v. .....;..., .;..;.......... ..+.. ...... ..n.. . ..... ..::... '>
... 3928 %8 ËË___Ë ë...Ë - 93:10 E ...:Qoe>za ...5 ...:0E5Ëoe ...>:...Ë...