CONCOURS COMMUN 2000
DES ÉCOLES DES MINES D'ALBI, ALÈS, DOUAI, NANTES
Épreuve spécifique de Physique et Chimie
(filière PCSI, option PC)
Mardi 23 mai 2000 de 08h00 à 12h00
Instructions générales :
Les candidats doivent vérifier que le sujet comprend 16 pages numérotées 1/16,
2/16 16/16.
Les candidats sont invités à porter une attention particulière à la rédaction :
les
copies illisibles ou mal présentées seront pénalisées.
Les candidats colleront sur leur première feuille de composition l'étiquette à
code
à barres correspondante.
Instructions particulières à l'épreuve spécifique de Physique et Chimie :
Toute application numérique ne comportant pas d'unité ne donnera pas lieu à
attribution de points.
Pour la partie Physique, les candidats auront à détacher puis à utiliser le
diagramme fourni en page 15/16. Ils inséreront ce diagramme dans les autres
feuilles de composition après avoir reporté au verso (page 16/16) leur code
d'inscription.
Épreuve spécifique de Physique et Chimie (filière PCSI, option PC) Page 1/16
PROBLÈME DE'CHIMIE
Partie A : réactions d'addition
A-I : Addition de dibrome sur un alcène
A-l-1 :Donner et nommer les formules topologiques de tous les alcènes non
cycliques contenant 4 atomes de carbone.
A-l-2 : L'un de ces isomères, noté C, est mis àréagir avec du dibrome Brz. On
obtient un seul produit dont la chaîne carbonée est linéaire. Identifier C.
Justifier en examinant le mécanisme de dihalogénation des alcènes.
A-II : Addition de bromure d'hydrogène sur un alcène
On met en présence le même alcène C avec HBr dans un solvant polaire.
A-ll-1 : Ecrire le mécanisme d'addition.
A--ll-2 : Montrer qu'on obtient, entre autres, la molécule D : 2-bromobutane (S)
dont on donnera la représentation spatiale selon Gram. Quelle est la
relation entre D et l'autre molécule D' obtenue ?
Partie B : Cinétique de substitution SNg
, On étudie l'action des ions iodures sur la molécule D (êA--ll-2) dans la
propanone :
un solvant peu polaire et aprotique.
B-I : Remarques sur le solvant
B-l-1 : Que signifie un solvant à la fois polaire et protique ? Donner au moins
deux
exemples de tels solvants.
B-l-2 : Rappeler comment un solvant peu polaire et aprotique favorise l'action
des
ions iodures sur la molécule D par un mécanisme SN2. On pourra
représenter le profil réactionnel du mécanisme SN2 et discuter selon
l'énergie d'activation de la réaction.
Épreuve spécifique de Physique et Chimie (filière PCSI, option PC) Page 2/16
B--II : Réactions du milieu
Le schéma réactionnel, c'est-à-dire les réactions possibles dans le milieu
(toutes
du type SN2), est :
M
(1) D+I' ---->E+Br'
k2
(2) E+I- ---->E'+I-
k2'
(2') E'+I- -->E+I--
k3
(3) E+Br'-->D+I'
k3'
(3') E' + Br '--> D' + I'
k1'
(1')D'+I' -->E'+Br-
k4
(4) D+Br'-->D'+Br'
k4v
(4') D' + Br '-->D + Br -
B-ll-1 : Identifier E et E'. Quelle relation y a-t-il entre ces deux molécules ?
B-ll-2 : Justifier que k1 = k1' , k2= k2' , k3= k3' et k4= k4'.
B-III : Comparaison des pouvoirs nucléophiles de I' et Br '
B-lll-1 : Donner la définition d'un nucléophile.
B-lll-2 : On donne les numéros atomiques Z(l) = 53 et Z(Br) = 35, le tableau des
constantes d'écran et les valeurs du nombre quantique principal n'
apparaissant dans l'approximation de Slater.
Groupe de l'électron Contribution des autres électrons
recevant l'écran
(nbrequant-n) n-1
Épreuve spécifique de Physique et Chimie (filière PCSl, option PC) Page 3/16
B-lll-2-a :
B-lll-2-b :
B-lll-2-c :
B-lll-2-d :
B-lll-2-e :
Donner la configuration électronique des ions iodure | 'et bromure Br"
en faisant apparaître les électrons dans un diagramme énergétique.
On rappelle que l'approximation de Slater fait apparaître des groupes
d'électrons ayant la même constante d'écran. On notera ces groupes
de Slater comme suit :
|:1s;ll:(2$,2p);lll:(3$,3p);lV:3d;V:(4s,4p);W:4d;
VII : (5s, Sp).
Déterminer pour chaque ion le nombre de charge effectif Z" associé au
dernier groupe de Slater occupé par les électrons. '
*2
Une formule approchee du rayon d'un ion est r...zZ,aO ou
ao = 53 pm est le rayon de Bohr et où n* et Z' sont relatifs au dernier
groupe de Slater occupé.
Déterminer r (l') et r (Br).
Comparer aux valeurs expérimentales r (l')=216 pm et
exp
rexp(Br') : 195 pm. Que dire de l'approximation de Slater ?
En se basant sur leur taille, justifier que les ions I' sont plus
nucléophiles que les ions Br".
En déduire qu'il est raisonnable de négliger les réactions (3), (S'), (4),
(4') du schéma réactionnel (Partie B-ll) et qu'il en est de même de la
réaction (1 ').
Ces hypothèses seront faites dans toute la suite du problème.
B-IV : Première expérience : détermination de k,
On étudie la cinétique précédente, seules les réactions (1), (2) et (2')
interviennent.
A l'instant initial, on introduit dans V=200 mL de solvant, n1 = 0,05 mole de D
et
n2 =0,1 mole de iodure de sodium Nal supposé dissout en ses ions Na* et l'.
A certains instants t, (i = 1,2,...), on prélève du milieu réactionnel un
échantillon de
volume v0 =10 mL. On le refroidit et on le dose par une solution aqueuse de
nitrate d'argent AgNO3 de concentration cAg : 0,2 mol.L".
Le suivi du dosage est réalisé par une méthode potentiomètrique où l'on observe
l'évolution de la différence de potentiel U = E Ag -- E,éf entre une électrode
d'argent
et une électrode de référence en fonction du volume v de nitrate d'argent
ajouté.
Épreuve spécifique de Physique et Chimie (filière PCSI, option PC) Page 4/16
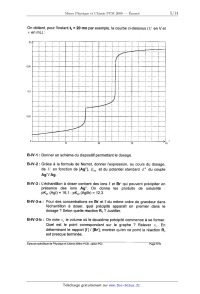
On obtient, pour l'instant t3
v en mL):
20 mn par exemple, la courbe ci-dessous (U en V et
-Û DE
-0 .3
.
.
.
.
r
.
.
.
.
.
-Û .55
du dispositif permettant le dosage.
ema
'
B-lV-1 : Donner un sch
donner l'expression, au cours du dosage,
"], Ere} et du potentiel standard E° du couple
?
B-lV-2 : Grâce à la formule de Nernst
de U en fonction de [Ag
Ag*l Ag.
doser contient des ions |" et Br" qui peuvent précipiter en
B-IV-3 : L'échantillon à
On donne les produits de solubilité
présence des ions Ag".
sz1(Agl)=1ôi1 : szZ (AgBr) = 12,3.
dre de grandeur dans
ème or
du m
, quel précipité apparaît en premier dans le
Pour des concentrations en Bret I
l'échantillon
3-a :
B-IV
doser
à
dosage ? Selon quelle réaction R1 ? Justifier.
former.
ase
Quel est le point correspondant sur,le graphe ? Relever v.
\
b : On note ve le volume où le deuxième précipité commence
3
B-IV
En
déterminant le rapport [l'] / [Br], montrer qu'en ce point la réaction R1
est presque terminée.
EUR
Épreuve spécifique de Physique et Chimie (filière PCSI, option PC)
Page 5/16
B-lV-3-c: Donner la relation entre cAg,ve etn1_ (n
iodures dans l'échantillon). ,
En déduire, à l'instant ta, la relation donnant la concentration en iodure
dans le milieu réactionnel ([l']M) en fonction de cAg,ve et vo.
[_ : nombre de mole d'ions
B-lV-4 : Dans le milieu réactionnel (M), on note les concentrations :
a = [D]M (à t = O) ; b = [l']M (à t = O) ; x = [l']M (à t quelconque).
On donne le tableau des concentrations des ions iodures, obtenues par
la méthode précédente, en fonction du temps :
5 t3= 20 -Iäl
x= tu.... (mol.L") 0,375 - 0277
B-lV-4-a : Exprimer et calculer numériquement a et b. Que peut-on dire de
l'effet
des réactions (2) et (2') sur la quantité d'ions iodures ?
En déduire les concentrations [D] et [Br] à l'instant t en fonction de a,
b et x.
B-lV-4--b : Compléter le tableau.
B-lV-4--c : Déterminer l'équation différentielle vérifiée par x, l'intégrer et
en
déduire l'expression de t en fonction de x, a, b et k1.
On rappelle--[ dx 1 X +cte
=--ln
(q+X)x q q+x
B-lV-4-d: En déduire k1 (en L.mol".s") par une méthode non graphique. On
présentera les valeurs numériques utilisées sous forme d'un tableau.
B-V : Deuxième expérience : détermination de k2
B-V-1 : On part d'un nouvel état initial, correspondant à l'état d'équilibre
obtenu
au bout d'un temps infini dans l'expérience précédente.
Donner la composition du système dans cet état, soit les valeurs de :
[Br']w , [I']°° , [D]°° , [E]oe et [E'].,° en fonction de c = 0,125 mol.L".
On pourra utiliser les'lois de conservation de la matière et le fait que les
concentrations n'évoluent plus.
Épreuve spécifique de Physique et Chimie (filière PCSI, option PC) Page 6/16
B-V-2 :
On modifie l'état précédent en doublant rapidement, à l'instant t = 0, la
concentration de l'espèce E. On sUit la réaction en observant le pouvoir
rotatoire a de la solution en fonction du temps. On obtient les résultats
suivants :
___--'-
...
Le pouvoir rotatoire a de la solution est donné par la formule :
a =ÆZ[a], c, où [ est la longueur de la cuve où l'on mesure a, [a], est
l'
le pouvoir rotatoire spécifique de la substance dissoute n°i et c, sa
concentration.
On note [a] le pouvoir rotatoire spécifique de l'espèce E.
On rappelle que celui de E' lui est opposé : [a]' = --[a].
B-V-2-a : Exprimer a à tout instant en fonction de [a], Z , [E] et [E'].
B-V-2-b: Les seules réactions mises en jeu ici sont (2) et (2'). Quelle est la
valeur de 0: lorsque t tend vers l'infini ? Que peut-on dire de [I'] au
cours de la réaction ?
B-V-2-c : A l'instant t quelconque, on note y la concentration dont a diminué
[E]
depuis l'instant initial.
Exprimer [E], [E'] puis a en fonction de c et y.
B-V-2-d : Exprimer la vitesse d'apparition de E' en fonction de k2, [I'], [E]
et [E'].
En déduire une équation différentielle vérifiée par a, l'intégrer et
donner a en fonction de ao (valeur initiale de a à t = 0), kg, c et t.
B-V-2-e: Grâce au tableau, déterminer la valeur de k2 par une méthode @
B-V-3 :
graphique (tableau des valeurs demandé).
Comparer k1 et k2. Ce résultat était--il prévisible ? Justifier.
FIN DU PROBLÈME DE CHIMIE
Épreuve spécifique de Physique et Chimie (filière PCSI, option PC) Page 7/16
PROBLÈME DE PHYSIQUE
Partie A : Satellite Hipparcos
Le satellite Hipparcos lancé le 8 Août 1987 était constitué principalement d'un
télescope de 30 cm de diamètre (étudié dans la partie B). Celui--ci a permis
d'établir un catalogue des positions, distances et éclats de plus de 118 000
étoiles
avec une précision jamais atteinte.
Ce satellite devait être placé sur une orbite géostationnaire à une altitude
H =36 000 km. Un problème de mise à feu du moteur d'apogée a laissé
Hipparcos sur son orbite de transfert son altitude variant entre h et H . Après
utilisation des moteurs de positionnement, l'altitude minimale a été portée à
h =500 km. Une programmation du satellite a permis de s'affranchir des
problèmes liés à cette orbite.
Au cours d'une révolution, il passe dans la ceinture de Van Hallen. On supposera
que cette ceinture est comprise entre deux sphères de rayon r, = 8 400 km,
r2 = 28 000 km et de centre celui de la terre. La ceinture de Van Hallen est
constituée de particules chargées piégées dans le champ magnétique terrestre.
Ces particules aveuglent les détecteurs d'Hipparcos interrompant les mesures des
positions des étoiles. Il est cependant utilisable à 65%.
On assimile la terre à une sphère de centre O, de rayon R = 6 400 km et de
masse M et le satellite à un point matériel (S, m). On suppose le référentiel
géocentrique Rgc galiléen. La période de rotation de la terre dans ce
référentiel
appelée jour sidéral vaut T = 86 164 3. On note G la constante de gravitation,
sa
valeur numérique n'est pas utile dans ce problème.
A --I : Moment cinétique
A-l-1 : Montrer que le moment cinétique 1Î en O du satellite est une constante
du
mouvement.
A-l-2 : On utilise les coordonnées cylindriques (O, Ü,, Ua, Ü, ) avec Ü, tel que
Z=LÜF
Montrer que le mouvement est plan et exprimer rZÔ en fonction de L et
m .
Quelle est le nom de cette grandeur ?
Épreuve spécifique de Physique et Chimie (filière PCSI, option PC) Page 8/16
A-II : Vecteur excentricité
_ -- L -- -- ,
A-ll-1 : Montrer que e = U9 ----G----îl--V est une constante du mouvement
(Vetant la
m
vitesse du satellite).
A-ll-2 : On choisit l'origine'de l'angle polaire pour avoir & =(ê,Üe). Montrer
que
l'équation de la trajectoire peut se mettre sous la forme : r(9)=----£----
1-- ecos(9)
où 6 est la norme de ê.
En déduire la trajectoire du satellite.
A-III : Trajectoire d'Hipparcos
A-lll-1 : Exprimer et calculer e et p en fonction de h, H et R.
A-llI-2 : Exprimer et calculer le demi--grand axe a de la trajectoire.
A-IV : Période d'Hipparcos
A-lV-1 : Enoncer sans démonstration la troisième loi de Kepler.
A-lV-2 : Exprimer la période Th de révolution d'Hipparcos en fonction de T, R,
H et h. Calculer Th en heure.
A-V : Ceinture de Van Hallen
A-V-1 : Déterminer les valeurs numériques des angles 91, 92 d'entrée et de
sortie
de la ceinture de Van Hallen du satellite. On donnera les valeurs
comprises entre 0 et 180°.
A-V-2: Représenter sur un schéma clair la trajectoire du satellite et l'aire A
balayée par OE' lors d'un passage dans la ceinture de Van Hallen.
Pour la question suivante, on prendra une valeur approchée de
A = 200.106 km?
A-V-3 : Déterminer le rapport p = --t°-- en fonction de A et Ae (aire de
l'ellipse) où
Th
to est la durée totale d'inactivité d'Hipparcos sur une période.
Commenter.
2
On donne l'aire de l'ellipse : Ae : "p
(1 _ e2 )3 / 2 .
Épreuve spécifique de Physique et Chimie (filière PCSI, option PC) Page 9/16
Partie B : Télescope d'Higp_arcos
On propose de modéliser le télescope d'Hipparcos par un miroir concave Mc de
rayon R = 2 800 mm avec un miroir plan Mp de renvoi (voir figure B--l). On note
8
le sommet du miroir concave. La lumière subit deux réflexions et passe par un
orifice dans le miroir concave pour atteindre le détecteur. Il est constitué
d'une
grille et de cellules CCD permettant de repérer la position de l'image. La
grille
comporte N = 2688 fentes équidistantes de [ = 8.2 um.
Figure B--I
B-I : On considère une étoile E visée dans la direction Sx. L'axe Sx est orienté
vers l'étoile.
B-l-1 : Déterminer l'abscisse x1 de l'image E1 de l'étoile E par le miroir MC.
B-l-2 : On note a la distance séparant le miroir plan et le sommet du miroir
concave. Déterminer une condition sur a pour que l'image finale E2 se
forme sur le détecteur placé à l'arrière du miroir concave.
B-l-3 : Déterminer la largeur angulaire occ du champ observé. Calculer orc en
degré.
B-II : En réalité Hipparcos réalise une mesure de position relative des
étoiles. Le
télescope vise deux directions symétriques par rapport à Sx présentant un
angle B = 58°. Ainsi on obtient avec une grande précision l'angle entre deux
étoiles. C'est un système de deux miroirs plans M1, M2 qui permet d'obtenir
les images des deux étoiles sur le détecteur (voir figure B-ll). Le télescope
' tourne autour d'un axe de direction Sz avec une période T = 128 minutes.
On supposera que la direction SZ est fixe bien que cet axe se déplace
lentement afin de viser toute la sphère céleste.
B-ll-1 : Déterminer l'angle (po des miroirs M1 et M2 avec l'axe Sx du télescope.
B--ll-2 : Déterminer le déplacement angulaire 91 d'un rayon lumineux réfléchi
par
le miroir M1 lorsque le satellite tourne d'un angle @. Préciser le sens de
déplacement des rayons réfléchis par M1 et M2.
B-ll-3 : Quelle est la norme Vde la vitesse de déplacement des images sur le
détecteur ?
Épreuve spécifique de Physique et Chimie (filière PCSI, option PC) Page 10/16
Figure B-II
sens de
rotation
du satellite
Partie C : Centrale Thermique
Une centrale thermique permet la production d'électricité à partir de la
combustion
de fuel ou de charbon. L'eau subit différentes transformations (décrites ci-
dessous) afin de produire un travail mécanique transformé en énergie électrique
grâce à un couplage de la turbine avec un alternateur (voir figure C).
- A l'entrée A du compresseur, l'eau est à l'état liquide saturé à la pression
P, = 0,2 bar. Elle subit une compression adiabatique réversible jusqu'à l'état
B de
pression P2 = 100 bar (1 bar = 105 Pa).
- Dans l'évaporateur, l'eau est en contact avec la chambre de combustion.
Elle subit un réchauffement isobare de B à C. Au point C, on donne la
température Tc = 500°C.
- Dans la turbine, l'eau subit une détente adiabatique réversible. On note D
le point de sortie de pression P, = 0,2 bar.
- Dans le condenseur, l'eau entre en Contact avec un circuit d'eau froide et
se condense jusqu'au point A. La transformation est supposée isobare.
Épreuve spécifique de Physique et Chimie (filière PCSI, option PC) Page 11/16
chambre
de '
' combustion '
...
_AAAM--
évaporateur
Figure C
arbre de couplage
compresseur turbine
condenseur
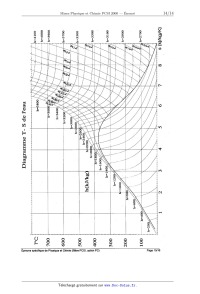
Pour faire l'analyse de cette centrale, vous utiliserez le diagramme
thermodynamique (T, s) de l'eau fourni en page 15/16.
il est constitué de réseaux de courbes isenthalpiques et isobares.
La courbe en "cloche" est constituée de la courbe de rosée et d'ébullition.
L'eau liquide étant peu compressible, on pourra confondre les points A et B.
C--I : État de l'eau au cours du cycle
_C-l-1:Placer les points A, C et D sur le diagramme. Vous donnerez les
explications nécessaires.
C-l-2 : En déduire l'état de l'eau en C, la température TA de l'eau en A et xD
la
fraction massique de vapeur au point D.
C-l-3 : Déterminer l'enthalpie massique hA, hC et hD aux points A, C et D.
C-II : Bilan énergétique
C-ll-1 : Déterminer %c et %A les transferts thermiques reçus par unité de masse
d'eau au cours des transformations isobares BC et DA.
C-ll-2 : En déduire le travail w reçu par unité de masse d'eau au cours d'un
cycle
et le rendement thermodynamique n de la centrale.
C-ll-3 : Quel est le débit en masse d'eau d nécessaire pour avoir une centrale
délivrant une puissance P = 250 MW ?
Épreuve spécifique de Physique et Chimie (filière PCSI, option PC) Page 12/16
C--III : Cycle à deux étages
Pour éviter la présence de vapeur d'eau dans la turbine à cause d'une détente
trop importante, on utilise deux turbines. On propose donc un cycle plus proche
de la réalité :
- Mêmes transformations de A à C.
- En C l'eau se détend dans une première turbine. On note D1 l'état à la
sortie. On suppose qu'en D1 l'eau est à l'état de vapeur saturée.
- L'eau repasse dans la chambre à combustion et subit un échauffement
isobare. On note C1 l'état de sortie.
- L'eau subit une détente dans une seconde turbine. On note D2 l'état à la
sortie. On suppose qu'en D2 l'eau est à l'état de vapeur saturée à la pression
P, = 0,2 Bar.
- Enfin, l'eau entre en contact avec le condenseur et est ramenée à l'état A.
La transformation est supposée isobare. '
Les détentes sont toujours supposées adiabatiques réversibles.
C-lll-1:Tracer le cycle de l'eau sur le diagramme (T,s). En déduire
PD1, TD1, PC1 et TC1.
C-lll-2: Déterminer qD1c1etqozA les transferts thermiques reçus par unité de
masse d'eau au cours des transformations D1 C1 et D2 A.
C-lll-3 : En déduire le travail W reçu par unité de masse d'eau sur un cycle et
le
rendement thermodynamique 11.
FIN DU PROBLÈME DE PHYSIQUE
Épreuve spécifique de Physique et Chimie (filière PCSI, option PC) Page 13/16
îôäâ w _, &
Swann ... ,
ooaNu: ...
oo ... mn.... ....
OOMMH£ - ,
£..ä
ooÈ...fln... $Ë.ËÜ%Ë%M
. @
..................lu--Êä«.
, COÛVH£
fimo; @@ m JH oâoeææoe...û
spécifique de Physique et Chimie (filière PCSI. option PC)
Épreuve