Centrale Physique et Chimie PSI 2008
| Thème de l'épreuve | Les déchets nucléaires |
| Principaux outils utilisés | cinétique, thermodynamique, oxydoréduction, systèmes linéaires, diffusion thermique, diffusion de particules |
| Mots clefs | radioactivité, extraction liquide/liquide, corrosion, plutonium, uranium, réacteur nucléaire, loi de Fourier, loi de Fick, système bouclé, fonction de transfert, stockage des déchets nucléaires |
Corrigé
: 👈 gratuite pour tous les corrigés si tu crées un compte👈 l'accès aux indications de tous les corrigés ne coûte que 5 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)









Rapport du jury
(télécharger le PDF)

Énoncé obtenu par reconnaissance optique des caractères
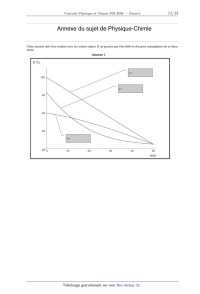
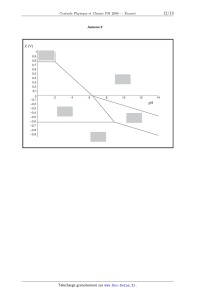
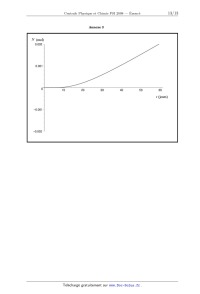
Concours Centrale - Supélec 2008 Épreuve : PHYSIQUE-CHIMIE Filière PSI PHYSIQUE-CHIMIE Filière PSI PHYSIQUE-CHIMIE Les calculatrices sont autorisées. Les différentes parties sont pour l'essentiel indépendantes. Déchets nucléaires Ce sujet aborde quelques aspects de la gestion des déchets nucléaires, de leur origine à un éventuel stockage en couche géologique profonde. Il s'agit ici uniquement de mettre en évidence certains aspects du problème, et de fournir des ordres de grandeur : on ne prétendra pas valider ou non la faisabilité du stockage. Un document-réponse est joint au sujet et devra être rendu avec la copie. Les données numériques ont été rassemblées à la fin du sujet. Partie I - L'origine des déchets I.A - La radioactivité La radioactivité est un phénomène physique naturel au cours duquel des noyaux atomiques instables se désintègrent en dégageant de l'énergie, pour se transformer en noyaux atomiques stables. L'évolution de la concentration c r ( t ) d'une substance radioactive suit une loi cinétique d'ordre 1 : dc r ( t ) ---------------- = c r ( t ) . dt I.A.1) Exprimer c r ( t ) en fonction de c r ( 0 ) , et t . L'usage est de caractériser l'activité d'un atome par sa période T , temps au bout duquel la concentration initiale a été divisée par deux. I.A.2) Relier et T . L'uranium présent dans l'écorce terrestre s'y trouve essentiellement sous forme 238 235 de deux isotopes : U et U : abondance T 238 99, 3 % 4, 5 10 ans 235 0, 7 % 0, 7 10 ans U U 9 9 I.A.3) En supposant qu'au moment de la création de la Terre les quantités des deux isotopes étaient égales, donner une évaluation de l'âge de la Terre. Concours Centrale-Supélec 2008 1/10 PHYSIQUE-CHIMIE Filière PSI Filière PSI 235 U possède la propriété d'être fissile : il peut capter un neutron lent ( n ) pour fissionner en plusieurs atomes plus légers et plusieurs neutrons rapides ( n ) . 140 235 93 Par exemple : U + n Kr + Ba + 3n . 235 En moyenne sur toutes les réactions possibles, chaque atome U qui fissionne libère 200 MeV et 2, 5 neutrons. 235 I.A.4) Évaluer l'énergie récupérable dans un gramme de U . I.A.5) Quelle masse d'octane ( C 8 H 18 ) , dont l'enthalpie de combustion vaut 1 5 kJ mol , faut-il brûler pour obtenir la même énergie ? Conclure. I.B - Modélisation du réacteur Cette énergie est récupérée au sein Fission d'un réacteur nucléaire. Le combusc m c* k1 tible nucléaire est essentiellement + 235 U (envide l'uranium enrichi en ron 4% contre 0, 7% pour le minerai naturel). Il est accompagné d'un modérateur (souvent de l'eau) k2 ------------------chargé de ralentir et d'absorber le 1 + 2 p surplus de neutrons dû à la fission. Figure 1 Enfin, il faut prendre en compte le Ralentissement, absorption, diffusion temps de diffusion 2 d'un neutron 235 avant qu'il ne soit capturé par un nouvel atome de U . Un réacteur peut alors être modélisé comme indiqué ci-dessus en figure 1 ( c et c représentent les concentrations en n et n ). m traduit l'action modératrice de barres de contrôles (signe ), qui peuvent être introduites mécaniquement dans le réacteur pour absorber des neutrons, avec une constante de temps 3 = 1 s . Dans la suite, on pose k = k 1 k 2 . I.B.1) m = 0 . Déterminer l'équation différentielle vérifiée par c ( t ) . I.B.2) Montrer que si le coefficient k est inférieur à une valeur k c à déterminer, le système est stable. La réaction de fission peut-elle être entretenue dans ces conditions ? c I.B.3) m 0 . Calculer la fonction de transfert H ( p ) = ----- . m Concours Centrale-Supélec 2008 2/10 PHYSIQUE-CHIMIE Filière PSI I.B.4) m = m 0, c ( 0 ) = c 0 . Montrer que l'équation différentielle vérifiée par c ( t ) s'écrit : dc = m0 . dt La résoudre complètement pour t > 0 . I.B.5) k > 1 . Montrer qu'il existe une valeur critique m c de m 0 telle que : m 0 > m c c ( t ) ( cas a ) ; m 0 < m c c ( t ) + ( cas b ) . ( 1 k )c + 2 I.B.6) Interpréter en une phrase le cas a . I.B.7) Interpréter en une phrase le cas b . 4 k = 1, 001 , 2 = 10 s . Calculer la constante de temps du réacteur. I.B.8) Conclure. Certains produits de fis235 sion des U sont radioac------------------+ 1 4 p tifs, et se désintègrent avec une période 4 » 2 : une fraction des neutrons c c* rapides est retardée. Le m k1 1 ++ + fonctionnement du réacteur est mieux modélisé par la figure 2 ci-contre. I.B.9) Donner la nouk2 Figure 2 velle fonction de transfert c T ( p ) = ----- du réacteur. m 235 I.B.10) k = 1, 001 . Pour U , 4 = 12 s et = 0, 65% . Définit et calculer la nouvelle constante de temps du réacteur. Comparer au résultat du I.B.8. 235 I.B.11) Lorsque que la teneur en U devient trop faible, en fin de vie du combustible, k diminue et le réacteur ne peut plus fonctionner. Justifier ces affirmations. I.C - Le retraitement La composition du combustible, pour 1000 kg de métal lourd initial, est donnée dans le tableau 1 ci-après. Le combustible usagé peut alors être retraité, pour séparer les divers éléments. Le retraitement consiste à concasser le combustible usagé, qui se présente sous forme d'oxydes, et à le dissoudre dans une solution aqueuse d'acide nitrique. Le plutonium et l'uranium se dissolvent suivant les réactions : U O 2 ( s ) + 4HN O 3 = U O 2 ( NO 3 ) 2 + 2 N O 2 + 2H 2 O ; Concours Centrale-Supélec 2008 3/10 PHYSIQUE-CHIMIE Filière PSI PuO 2 ( s ) + 4HN O 3 = Pu ( N O 3 ) 4 + 2H 2 0 Tableau 1 : atome 235 Actinides majeurs U 238 U Autres U 239 Pu combustible neuf ( kg ) combustible usagé ( kg ) 37 7 963 929 - 8 - 10 Actinides mineurs Np , Am , Cm - 1 Produits de fission Cs , Sr , Tc , ... - 35 I.C.1) Préciser les nombres d'oxydation de N dans N O 3 et N O 2 . Une de ces réactions est une réaction d'oxydoréduction. Laquelle ? I.C.2) En déduire les nombres d'oxydation de U et Pu dans les produits de ces réactions. Les produits de dissolution des autres actinides, Np , Am et Cm , ont pour nombres d'oxydation respectifs +V , +III et +III . Dans cette solution aqueuse ( A 0 ) , 2 1 la concentration totale en Pu vaut [ Pu ( aq ) ] 0 = 10 mol L . Elle est mélangée à une solution organique ( O 0 ) de phosphate de tributyle ( TBP ). Après agitation et décantation, chaque élément X se partage entre les deux phases ( A 1 ) et ( O 1 ) , non miscibles, ainsi obtenues. Le coefficient de partage est défini par [ X ( org ) ] D p = -------------------- , où [ X ( f ) ] représente la concentration totale en élément X [ X ( aq ) ] 2 dans la phase f . Pour les actinides, D p = 10 si le nombre d'oxydation est pair, 2 D p = 10 sinon. D p est également très faible pour les produits de fission. I.C.3) On mélange 1 L de la solution aqueuse ( A 0 ) avec 10 L de TBP . Après agitation et décantation, on sépare ( A 1 ) et ( O 1 ) . Calculer [ Pu ( aq ) ] 1 dans la solution ( A 1 ) . I.C.4) L'opération est répétée une seconde fois : on mélange 1 L de la solution aqueuse ( A 1 ) avec 10 L de TBP . Après agitation et décantation, on sépare ( A 2 ) et ( O 2 ) . Calculer [ Pu ( aq ) ] 2 dans la solution ( A 2 ) . Concours Centrale-Supélec 2008 4/10 PHYSIQUE-CHIMIE Filière PSI I.C.5) Dans quelle phase se trouvent maintenant les déchets ultimes, produits de fission et actinides mineurs ? Ceux-ci sont alors vitrifiés et placés dans des colis en acier (Déchets C). ( O 1 ) et ( O 2 ) sont rassemblées pour former ( O 3 ) . ( O 3 ) est mélangé à une solution aqueuse ( A 3 ) de nitrate uraneux U ( N O 3 ) 4 en excès. Celui-ci agit avec le plutonium selon la réaction : 2Pu 4+ +U 4+ + 2H 2 O = 2Pu 3+ 2+ + + U O 2 + 4H . Soient ( A 4 ) et ( O 4 ) les phases obtenues après agitation et décantation. I.C.6) Quel est l'intérêt de cette dernière opération ? Partie II - Le stockage de déchets Les parties suivantes étudient de manière extrêmement simplifiée la possibilité d'un stockage géologique de ces déchets, sous une couche argileuse d'épaisseur l = 50 m (Figure 3). Les vecteurs seront notés en gras. II.A - Aspect thermique x Du fait de la radioactivité des produits de fission, l les déchets sont très exothermiques. Le champ de température T ( x, t ) est supposé unidimensionnel, dans un cylindre d'argile (masse volumique a , conductivité thermique K a , capacité calorifique massique c a , diffusivité thermique D T ) de section S . L'énergie thermique s'évacue suivant la loi de Fourier : 0 j T ( x, t ) = K a grad ( T ) . II.A.1) S Argile Quel est le nom et l'unité du vecteur j T ( x, t ) ? Figure 3 II.A.2) Établir l'équation de la chaleur vérifiée par T ( x, t ) . II.A.3) Relier D T aux caractéristiques de l'argile. II.A.4) Interpréter le résultat obtenu lorsqu'on remplace t par t dans l'équation de la chaleur de la question II.A.2. Après 30 ans d'entreposage en surface, N colis de déchets C sont uniformément répartis sur la surface S en ( x, t ) = ( 0, 0 ) . La puissance dégagée par un colis suit t / approximativement la loi p ( t ) = p 0 e avec p 0 = 1 kW et = 43 ans . II.A.5) Interpréter les conditions aux limites : T Np ( t ) T ( x, 0 ) = T 0 ; T ( l, t ) = T 0 ; ------- ( 0, t ) = ---------------- . x 2K a S Concours Centrale-Supélec 2008 5/10 PHYSIQUE-CHIMIE Filière PSI La solution T ( x, t ) est représentée sur l' annexe 1, au bout de 10 , 40 et 100 ans, avec T 0 = 25° C , dans le cas où la température maximale tolérée est de 100° C . II.A.6) Compléter le diagramme de l'annexe 1 en identifiant les trois courbes et en justifiant rapidement. 1 1 II.A.7) K a = 1, 5 W K m . À partir de ce diagramme, expliquer comment on peut accéder à la surface nécessaire à l'enfouissement du stock des déchets C français, estimé à 36 000 colis. Donner une estimation numérique de cette surface. II.A.8) Il est envisageable d'attendre 30 années supplémentaires avant d'enfouir les déchets en profondeur. Quelle est la nouvelle surface de stockage nécessaire ? II.B - Confinement des déchets Les colis en acier (assimilé ici à du fer) ont pour but de retarder le contact entre les déchets et l'argile. Cette partie étudie l'interaction d'un colis avec l'eau présente dans l'argile. L'annexe 2 donne le diagramme potentiel pH du fer, à T = 25° C , tracé pour une concentration de référence C R (à déterminer) pour les 2+ 3+ espèces solubles. Les espèces prises en compte sont : Fe ( s ) , Fe , Fe , FeOOH ( s ) (goethite) et Fe 3 O 4 ( s ) (magnétite). II.B.1) Compléter le diagramme en précisant les espèces associées aux différents domaines. II.B.2) Établir la configuration électronique du fer ; en déduire celle des ions 2+ 3+ ferreux Fe et ferriques Fe . 2+ II.B.3) Déterminer la valeur du potentiel standard E° ( Fe / Fe ( s ) ) à 25° C . Faire l'application numérique. Pourquoi f G° ( Fe ( s ) ) est-elle nulle ? II.B.4) En déduire, à l'aide du diagramme, la concentration de référence C R choisie. II.B.5) Déterminer par le calcul la pente de la frontière entre les domaines de 2+ . II.B.6) Déterminer par le calcul les coordonnées du point d'intersection des 2+ domaines de Fe ( s ) et Fe 3 O 4 ( s ) et Fe . II.B.7) Donner les équations des frontières du diagramme potentiel pH de l'eau (aux frontières, la pression sera prise égale à P° = 1 bar pour les espèces gazeuses). Représenter ces frontières sur l' annexe 2. II.B.8) Pendant la phase de remplissage, le site de stockage souterrain est bien ventilé, l'oxydant est l'oxygène. Quel est alors le produit solide de corrosion du fer ? Fe 3 O 4 ( s ) et Fe Concours Centrale-Supélec 2008 6/10 PHYSIQUE-CHIMIE Filière PSI Une fois le site de stockage fermé, la présence d'argile impose un pH voisin de 8 et un potentiel voisin de 0, 3 V . Le seul oxydant présent est l'eau. II.B.9) Quel est alors le produit de corrosion du fer ? Écrire l'équation-bilan correspondante ( E 1 ) , pour une mole d'oxyde formé. II.B.10) La vitesse de corrosion d'un colis (diminution de son épaisseur par unité de temps) au sein du stockage est approximativement multipliée par deux lorsque la température passe de 25° C à 80° C . En déduire une énergie d'activation apparente E a , et donner sa valeur numérique en kJ mol 1 . Aux temps longs, la densité de courant j s associée à la corrosion, conformément à l'équation ( E 1 ) , est estimée à 2 mA m 2 . II.B.11) Exprimer la vitesse de corrosion (diminution de l'épaisseur par unité de temps) en fonction de j s , M ( Fe ) , ( Fe ) et F . Application numérique : évaluer le temps nécessaire pour corroder un colis de 50 mm d'épaisseur. On donne ( Fe ) = 7690 kg m 3 . II.B.12) Déterminer le volume de dihydrogène gazeux produit par unité de temps et par unité de surface du colis, en considérant que H 2 ( g ) est produit à T = 25° C et P = P° = 1 bar . 2 1 Application numérique : exprimer le résultat en L m an . II.B.13) Une partie du dihydrogène s'accumule au voisinage du colis. Quelle est l'avantage de cette accumulation, du point de vue thermodynamique ? II.B.14) Les produits de corrosion solides ont en général une masse volumique inférieure à celle du fer, d'où un phénomène d'expansion. On met ici en évidence ce phénomène sur le cas simple de l'oxyde ferreux FeO , de masse volumique ( FeO ) = 5900 kg m 3 . En déduire la valeur numérique du facteur de gonflement f , rapport du volume d'oxyde formé sur le volume de fer oxydé. Quelle conséquences cela peut-il avoir ? Les espèces chimiques issues des colis de déchets sont susceptibles d'interagir avec les produits issus de la corrosion. Par exemple, à la surface d'un oxyde de fer, il apparaît des sites amphotères, notés FeOH . Ces sites seront considérés comme des espèces en solution, en assimilant notamment leur activité chimique à leur concentration. Ces sites sont susceptibles d'accepter ou de céder un proton + + H ; les pKa respectifs des couples acido-basiques FeOH 2 / FeOH et FeOH / FeO sont notés pK a1 et pK a2 . Le « point de charge nulle » de l'oxyde de fer est défini comme le pH pour lequel sa surface est globalement neutre. Concours Centrale-Supélec 2008 7/10 PHYSIQUE-CHIMIE Filière PSI + II.B.15) Quelle est au point de charge nulle la relation entre [ FeOH 2 ] et [ FeO ] ? Établir en ce point l'expression du pH , en fonction de pK a1 et pK a2 . II.B.16) En déduire, qualitativement, dans quelles zones de pH respectives des cations ou des anions pourront se fixer préférentiellement à la surface de l'oxyde. II.B.17) Sachant que le point de charge nulle de la magnétite est proche de 6 , quelles conséquences cela peut-il avoir pour des actinides présents sous forme de cations, tels que Am 3+ ou Cm 3+ par exemple ? De nombreuses espèces sont ainsi fortement retenues dans les produits d'altérations des verres et des colis. II.C - Barrière géologique On s'intéresse maintenant à une espèce non retenue au voisinage du colis. Cette espèce est alors susceptible de diffuser dans l'argile environnante. La géométrie utilisée est la même que dans la partie II.A (figure 3), et le problème est encore considéré unidimensionnel. On négligera ici la décroissance radioactive des concentrations. Simultanément à la diffusion, une partie des déchets se fixe dans l'argile (phénomène de sorption). On écrit donc la concentration totale de l'espèce considérée (en mol m 3 ) sous la forme c t ( x, t ) = c ( x, t ) + c f ( x, t ) , où c ( x, t ) et c f ( x, t ) représentent respectivement la concentration en espèce mobile et la concentration en espèce fixée. Ces deux concentrations sont liées par c f ( x, t ) = K s c ( x, t ) , où K s est une constante. Le vecteur densité de courant de particules (en mol m 2 s 1 ) s'obtient alors par la loi de Fick, à partir de la concentration c ( x, t ) en espèce mobile j c ( x, t ) = Dgrad ( c ) , où D est le coefficient de diffusion (en m 2 s 1 ) de l'espèce mobile. II.C.1) À l'aide d'un bilan de matière dans une tranche d'argile de section S , comprise entre x et x + dx , montrer que c ( x, t ) vérifie une équation de diffusion : 2 c c D --------2- = ----- , t x où l'on exprimera D en fonction de D et K s . On impose les conditions aux limites : c ( 0, t ) = C 0 c ( l, t ) = 0 c ( 0 < x < l, 0 ) = 0 Concours Centrale-Supélec 2008 8/10 PHYSIQUE-CHIMIE Filière PSI II.C.2) Justifier que la solution c 0 ( x ) de l'équation de la diffusion en régime permanent soit une fonction affine de x . Expliciter complètement cette solution. On pose c ( x, t ) = c 0 ( x ) c ( x, t ) . II.C.3) Donner l'équation et les conditions aux limites vérifiées par c ( x, t ) . On cherche pour c une solution de la forme c ( x, t ) = f ( x ) g ( t ) où f ( x ) et g ( t ) sont deux fonctions à déterminer. t / II.C.4) Montrer que g ( t ) est nécessairement de la forme Ae , où A et sont deux constantes. Justifier > 0 . II.C.5) En déduire la forme de f ( x ) . En tenant compte des conditions aux limites en x = 0 et x = l , montrer que ne peut prendre que les valeurs discrètes 2 n = 1 / n , où n est un entier non nul, et préciser la valeur de 1 en fonction de D et l . La fonction c *0 ( x ) , périodique de période 2l , impaire, et qui coïncide sur ] 0, l [ avec c 0 ( x ) admet comme développement en série de Fourier : 2C 0 c *0 ( x ) = --------- II.C.6) + n=1 1 x --- sin n --- . n l Vérifier soigneusement que 2C 0 c ( x, t ) = c 0 ( x ) --------- + n=1 x 1 t --- sin n --- exp ----- l n n est solution de ce problème de diffusion. II.C.7) Donner l'expression littérale du flux ( l, t ) à travers la surface S , en x = l. II.C.8) En déduire la quantité de matière N ( t ) évacuée à la surface entre 0 et t ; on donne : + n 2 ( 1 ) ------------- = ------ . 2 12 n=1 n II.C.9) Montrer que N ( t ) admet une asymptote pour t » 1 , dont les paramètres permettent de déterminer les valeurs de D et de D . La courbe expérimentale de l'Annexe 3 a été réalisée pour une expérience + modèle de diffusion des cations lithium Li dans une argile, avec 2 1 2 C 0 = 10 mol L , S = 30 cm et l = 0, 5 cm . II.C.10) En déduire graphiquement les valeurs numériques de D et D . Calculer K s . II.C.11) Déterminer l'ordre de grandeur du temps nécessaire au lithium pour atteindre la biosphère, que l'on considérera distante de 50 m . Quel serait ce temps en l'absence de sorption ? Concours Centrale-Supélec 2008 9/10 PHYSIQUE-CHIMIE Filière PSI Données : Constante des gaz parfaits R 8, 32 J K F Constante de Faraday 1 eV NA Nombre d'Avogadro mol 1 96 500 C e Charge élémentaire 1 1, 6 10 19 1, 6 10 19 C J 6, 02 10 23 mol 1 Numéro atomique Z Masse molaire M ( g mol 1 ) C 6 12 H 1 1 O 8 16 Fe 26 56 Les données suivantes sont fournies à 25°C RT 2, 3 --------- ln = 0, 06 log . F Potentiel standard ( E° ) O2 ( g ) / H 2 O( l ) 2+ Fe 3 O 4 ( s ) / Fe ( aq ) enthalpie libre standard de formation ( f G° ) 1, 23 V Fe 0, 98 V H 2+ + 85, 0 kJ mol 1 0 ··· FIN ··· Concours Centrale-Supélec 2008 10/10 Annexe du sujet de Physique-Chimie Filière PSI Annexe du sujet de Physique-Chimie Cette annexe doit être rendue avec les autres copies. Il ne pourra pas être délivré d'autres exemplaires de ce document. Annexe 1 Concours Centrale-Supélec 2008 1/3 Annexe du sujet de Physique-Chimie Filière PSI Filière PSI Annexe 2 Concours Centrale-Supélec 2008 2/3 Annexe du sujet de Physique-Chimie Filière PSI Annexe 3 N Concours Centrale-Supélec 2008 3/3