Centrale Physique et Chimie PSI 2000
| Thème de l'épreuve | Étude des sphères en physique et détermination de certaines constantes fondamentales |
| Principaux outils utilisés | mécanique des fluides, mécanique du point, thermochimie, électrochimie, cristallographie |
Corrigé
: 👈 gratuite pour tous les corrigés si tu crées un compte👈 l'accès aux indications de tous les corrigés ne coûte que 5 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)








Rapport du jury
(télécharger le PDF)


Énoncé obtenu par reconnaissance optique des caractères
PHYSIQUE--CHIMIE Filière PSI
PHYSIQUE-CHIMIE
La musique des sphères
(ou quelques apports de l'étude d'une sphère à la physique et à la chimie)
Dans tout le problème les vecteurs % seront notés x et ex , e y , ez désignent
des
vecteurs unitaires.
Données numériques :
Accélération de la pesanteur g = 9, 81 m 3--2
Masse volumique de l'air pa : 1, 29 kg nf3
Viscosité de l'air na : 1, 8 - 10 _5 P1
Masse volumique du cuivre pCu : 8, 92 - 10 3 kg m_3
Masse molaire atomique du cuivre M Cu : 63, 57 g mol--1
Partie I - Évaluation de la constante d'Avogadro par l'étude
cristallographique du matériau
Une sphère est réalisée en cuivre, lequel cristallise selon une structure type
cubique compact dont le paramètre de maille vaut 362 pm. La sphère pleine
(boule) de rayon R = 0,5 cm a une masse m égale à 4, 67 g.
I.A - Le numéro atomique du cuivre est Z = 29. Donner sa configuration élec-
tronique en précisant les règles utilisées. Le cuivre est-il un métal de
transition ?
I.B - Dessiner la maille élémentaire du cuivre. La qualité du schéma sera appré-
ciée. Placer sur le schéma les sites intersticiels, donner leur type, leur
nombre
ainsi que le nombre d'atomes par maille.
I.C -
I.C.1) Quelle relation existe-t-il entre m, R , MCu et N A, où N A est la
constante d'Avogadro ?
1.0.2) Déterminer une valeur numérique pour N A . Vous veillerez à donner la
précision correcte pour cette détermination.
Concours Centrale-Supélec 2000 1/10
PH YSIQUE--CHIMIE Filière PSI
Filière PSI
Partie II - Ècoulement d'un fluide visqueux autour d'une
sphère
On considère dans toute cette partie un fluide newtonien visqueux de viscosité
n , incompressible et de masse volumique p .
II.A - Notion de viscosité
II.A.1) En considérant un écoulement unidirec-
tionnel, tel que v = v(y,t)ex, exprimer la force
qu'exerce l'élément de fluide S1 sur l'élément de
fluide S2 du schéma ci-contre.
La surface de contact des deux éléments de fluide
est notée S .
II.A.2) En déduire que l'on peut définir une force
volumique de cisaillement dont on donnera
l'expression dans le cas du champ étudié ici. On admettra par la suite que
l'effet
de la viscosité peut être traduit par une force volumique d'expression nAv quel
que soit le champ des vitesses (Av est le Laplacien du champ vectoriel v ).
II.A.3) En déduire l'expression que prend dans ce cas l'équation locale de la
dynamique du fluide si celui-ci n'est soumis à aucune autre force volumique.
II.B - Écoulement autour d'une sphère
Par la suite, on s'intéresse à l'écoulement d'un fluide visqueux autour d'une
sphère de rayon R , en l'absence de toute autre force que celle de viscosité. On
utilisera le repère de projection en coordonnées sphériques r, 6, (p d'axe Oz
où 0
est le centre de la sphère. À grande distance de la sphère, l'écoulement du
fluide
est uniforme v : Vo ez et la pression dans le fluide est P0 .
II.B.1) Bâtir à partir des grandeurs caractéristiques du fluide p , n , VO une
grandeur DO homogène à une distance.
II.B.2) Exprimer le nombre de Reynolds relatif à l'écoulement étudié à partir
de D : 2R (prise comme distance caractéristique de l'écoulement) et D0 .
II.B.3) Le fluide considéré est de l'air de vitesse V0 = 10 m s_1. Calculer le
nombre de Reynolds pour une sphère de rayon 0, 5 cm , puis pour une sphère de
Concours Centrale-Supélec 2000 2/ 10
PH YSIOUE--CHIMIE Filière PSI
rayon 0, 5 mn . Comment peut--on qualifier l'écoulement dans ces deux cas ?
Des--
siner sommairement l'allure des lignes de courant correspondantes.
La force résultante, appelée traînée, correspon-
dant aux actions du fluide sur la sphère est
notée F, avec F = F ez.
II.B.4) Justifier que le coefficient de traînée
de la sphère
F
Cx : _2_â
(1/2)pV0nR
ne dépend que du nombre de Reynolds pour un
fluide fixé.
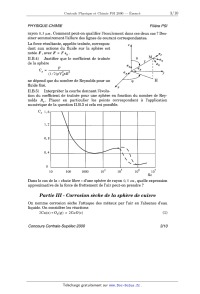
II.B.5) Interpréter la courbe donnant l'évolu-
tion du coefficient de traînée pour une sphère en fonction du nombre de Rey-
nolds Re . Placer en particulier les points correspondant à l'application
numérique de la question II.B.3 si cela est possible.
Dans le cas de la << chute libre » d'une sphère de rayon 0, 5 cm , quelle expression approximative de la force de frottement de l'air peut-on prendre ? Partie III - Corrosion sèche de la sphère de cuivre On nomme corrosion sèche l'attaque des métaux par l'air en l'absence d'eau liquide. On considère les réactions 2Cu(s)+02(g) : 2CuO(s) (1) Concours Centrale-Supélec 2000 3/10 PH YSIOUE--CHIMIE Filière PSI 4Cu(s)+02(g) : 2Cu20(s) (2) 2Cu2O(s)+02(g) = 4CuO(s) - (3) On donne en J - mol--1 A,G1°(T) = _ 314600 + 186, 2 - T A,G2°(T) = 437200 + 151, 6 - T III.A - Déterminer ArG3°(T) . III.B - Dismutation de l'oxyde de cuivre (I) III.B.1) Écrire l'équation--bilan traduisant la réaction de dismutation de l'oxyde de cuivre (I ). III.B.2) Déterminer et étudier la variance de cet équilibre. III.B.3) Conclure quant à la stabilité de l'oxyde de cuivre (I) . III. C- Tracé du diagramme On réalise un diagramme en portant() en ordonnées RT ln(P(OZ)/P0 ) et en abs- cisses la température T en Kelvin (P0 , pression de référence, est égale a 1 bar.) III. C. 1) Porter sur ce diagramme les points correspondant aux équilibres (1), (2) et (3). Échelle: 10 cm pour 100 k] mol_1 ;] cm pour 100 K. III.C.2) Indiquer, en justifiant la réponse, quelles sont les espèces stables et quels sont leurs domaines de stabilité. III.C.3) Quel est l'oxyde stable quand le cuivre est en contact avec l'air de l'atmosphère (P(02) : 0,2 bar) à la température T ? III.C.4) Est-il possible que le cuivre ne soit pas attaqué ? Partie IV - Mesure de la charge de l'électron et nouvelle évaluation de N A NA - Expérience de Millikan L'électron a été la première particule élémentaire mise en évidence et son accep- tation par la communauté scientifique a nécessité près d'un siècle, depuis la caractérisation des lois de l'électrolyse par Faraday en 1833 jusqu'à la recon- naissance de l'électron vers 1920. Mais la détermination approximative de la masse et de la charge du corpuscule par Joseph John Thomson en 1897 marque la date de la découverte de l'électron. Les expériences de Millikan (à partir de 1909) ont permis la première détermination précise de la charge de l'électron. Concours Centrale-Supélec 2000 4/10 PH YSIQUE-CHIMIE Filière PSI Thomson avait pu mesurer avec précision le rapport charge/masse de l'électron. Décrire un exemple d'expérience simple réalisée au lycée, ou de dispositif utilisé dans la recherche ou l'industrie, permettant de mesurer ce rapport. Présentation de l'expérience de Millikan En utilisant un pulvérisateur d'huile (A) , on crée de petites gouttelettes sphé- riques d'huile de rayon a de l'ordre du micromètre. Sous l'action de la pesanteur, elles tombent à travers un trou à l'intérieur d'un condensateur plan constitué des deux armatures M et N . Lors de leur pulvérisation, les gouttelettes sont électrisées par frottement. Elles peuvent aussi l'être entre les armatures à l'aide d'une source (X) de rayons X . On observe le mouvement de ces gouttelettes dans le condensateur à l'aide d'une lunette de visée (T) . On mesure en fait leur vitesse limite de chute en fonction de la différence de potentiel entre les arma- tures M et N . Hëb ...Ï X IV.B - Mécanique La force de frottement visqueux due à l'air est donnée par la formule de Stokes : F : --6nnaavez . L'axe Oz sera orienté dans le sens de la verticale descendante. IV.B.1) Exprimer la résultante des forces exercées sur une gouttelette en fonc- tion de son rayon a , de sa masse volumique p H , de la masse volumique de l'air pa , de l'accélération de la pesanteur g , de la viscosité de l'air na , de la charge q de la gouttelette, de la distance D entre les armatures (M) et (N) et de la dif- férence de potentiel V : VM -- VN. IV.B.2) Montrer qu'après un régime transitoire la gouttelette prend une vitesse limite fonction de la différence de potentiel V : voe(V) . Donner une esti- mation de la durée du régime transitoire (la résolution de l'équation différen- tielle est inutile, un raisonnement dimensionnel suffit). IV.B.3) Dans le cas d'une différence de potentiel nulle, on note v0oe la valeur de la vitesse limite. Montrer que le rayon de la gouttelette est donné par a : k1 /v0oe. Exprimer k1 en fonction des données na, pH, pa , g. Concours Centrale-Supélec 2000 5/10 PHYSIQUE--CHIMIE Filière PSI lV.B.4) On appelle Vo la différence de potentiel pour laquelle la vitesse limite est nulle. Montrer que la charge de la gouttelette est donnée par une formule du type Exprimer k2 en fonction de p H, pa , g, k1 et D. On prendra par la suite les valeurs calculées : k1 = 1,018-10'4 5.1. et |k2| = 2,071 -10'10 5.1... et: pH : 800kg-m*3 etD : 6mm. NE. 5) Déterminer l'ordre de grandeur de la durée du régime transitoire, cal- culer la valeur de la vitesse limite v0oe pour une gouttelette de rayon 119 um et la différence de potentiel d'arrêt V0 pour une charge q-- _ e -- _,1 60 10--19.C Con-- clure quant à la faisabilité de l'expérience. IV.C - Optique La lunette de visée permet de mesurer la vitesse verticale des gouttelettes. Elle peut être schématisée gouttelette \) par un système de deux lentilles conver-- gentes : l'objectif L1 de distance focale { __ +( _ _ _ .) image f1 et l'oculaire d / L2 de distance focale image f 2 . Dans le plan focal objet de L2 , on a placé un micromètre (échelle gra- duée). micromètre L'Observateur n'accommode pas et voit donc net un objet « à l'infini >>. La lon-
gueur / de la lunette est réglée de telle façon qu'une gouttelette située àla
dis-
tance d de l'objectif est vue nette à travers la lunette.
IV.C.1) Pourquoi le micromètre est--il placé dans le plan focal objet de L2 ?
Pourquoi est--il nécessaire de placer l'oeil à proximité de l'oculaire ?
IV.C.2) Quelle relation entre d , / , f1 et f 2 traduit le réglage de netteté
de la
lunette ?
IV.C.3)
Concours Centrale-Supélec 2000 6/10
Filière PSI
PH YSIQUE--CHIMIE
a) On repère la position verticale 2 de la gouttelette par la graduation z' lue
sur le microm
ètre. Quelle est l'expression de la vitesse verticale v d'une goutte-
O, 5 cm et
pondant à
: f2
tre corres
=20m
è
/etf2.
b) Déterminer les valeurs de d et / sachant que f1
lette si, pendant une durée 1 , elle s'est déplacée de Az' graduations ? On
expri-
d,
qu'en 1:
mera cette vitesse en fonction de Az' , "E ,
était don-
1née
érique. Justifier le
A
écida d'apporter
le microm
| mesuré sur
-|
est de 0,5 mm.
|Az'
01 mm 5
,
éplacement
10sled
\
Résultats
IV.D.1) A la vue de ses résultats expérimentaux, Millikan d
une correction àla formule de Stokes. Il postula que la force de tra
une gouttelette de vitesse 0
ND-
ù P est la pression atmosph
fait que le terme correctif est en valeur relative plus important pour a et P
2 0
--61ma(a + b/P)ve
F:
)
nee par
11 augmente quand la pression diminue.
m et qu"
sachant que le libre parpours moyen d'une molécule de gaz dans l'air est
de l'ordre de grandeur de 2 - 10
petits,
)v0oe.
t
%
P
& b_a
+
& 1
m (
M k1
r __
&
P a
e C
fæ e
i v
fl &
t
u &
e 3)
1
P
m 1 m
fi b
.oe +
m 1
2
?. /oe_ 0
f... 3......2V
a k
L __
\) q
2.
D.
V
Tl
_J._
_J.__J._l_J--L _L_
_.L__J._-J-L _L__L__ __J-L--_l-- _I_L_
_I_L_
-4--h4-- ---+--
|
-4.-
|
| ||
-+-- ----4-k4 4--+--
| || |. | |
--1--r1-- fi--r--
_ ___|--l'î-- __T_
"T"
"T'"T'F'l"r "r"
-1.__ _
-]..-
_J.__J._LJ-L _L_
..J-L..I- _l_L_
_+_
_T_
_+_
I
_.r_
| ||
-- --F4--F4-- --
| ||
_ '"'|'r'|' _
| ||
--+----4--H4--F --F----+--
| |
_T__T_
'\'F"
Concours Centrale-Supélec 2000
PH YSIOUE--CHIMIE Filière PSI
Comme le coefficient b était inconnu, il décida de faire une première estimation
de la charge élémentaire et de b en introduisant les valeurs approchées
3/2
0000
"PP
Donner à partir des points du graphique précédent, une estimation de A = b/ P
et de la charge élémentaire.
Remarque : l'expérience a été faite en suivant successivement 8 gouttes dont la
charge a été modifiée à l'aide de la source(X ) .
IV.E - Nouvelle évaluation de la constante d'Avogadro
L'électrolyse d'une solution aqueuse de sulfate de cuivre à 2 mol - L "1
contenant
1 mol - L'1 d'acide sulfurique est réalisée avec une cathode en cuivre et une
anode en plomb. Données :
E°(02(g)/H20(/)) = 1,23 v ;E°(Cu2+(aq)/Cu(s)) = 0,34 v ;
E°(H20(/)/H2(g)) = 0,00 v ;E°(Pb2+(aq)/Pb(s)) = -0, 14 v ;
E°(Ag+(aq)/Ag(s)) = 0,80 v ; E°(Zn2+(aq)/Zn(s)) = _ 0,77 v
E°(SOÎ'/SOÛ = 0,17 v ; pKa(Hsog/soî--) = 1,8 ; sz(PbSO4) = 7,7.
IV.E.1)
a) Écrire les équations bilan des réactions pouvant se produire à la cathode.
b) Écrire les équations bilan des réactions pouvant se produire à l'anode.
c) Il y a passivation de l'anode. En donner une interprétation.
d) Quel est le bilan chimique de l'électrolyseur ?
IV.E.2) L'électrolyse précédente est reprise mais avec deux électrodes en cui-
vre.
a) Ecrire les réactions à chaque électrode en supposant que les surtensions sont
négligeables.
L'électrolyse est tout d'abord réalisée avec du cuivre ultra pur, la masse de
cui-
vre déposée à la cathode est égale à m = 532 mg lorsque la quantité
d'électricité
passant dans l'électrolyseur est q = 1615 C .
b) Comment peut-on mesurer la quantité d'électricité passant dans
l'électrolyseur ?
0) Déterminer une valeur de la constante d'Avogadro en prenant 1, 60- 10_19 C
comme valeur pour la charge élémentaire.
d) En fait l'électrode de cuivre n'est pas parfaitement pure et contient des
impu--
retés que nous schématiserons par des traces d'argent et de zinc. Les réactions
Concours Centrale-Supélec 2000 8/10
PH YSIQUE--CHIMIE Filière PSI
principales de l'électrolyse ne sont pas modifiées. Que deviennent le zinc et
l'argent au cours de cette électrolyse '? Ecrire les réactions qui se
produisent.
Partie V - Établissement de la formule de Stokes
On reprend les hypothèses et les notations des deux premières parties. On se
place en régime permanent et on suppose que la vitesse est suffisamment faible
pour négliger le terme quadratique d'accélération convective (approximation
linéaire).
V.A - Quelles sont, dans ce cas, les conditions imposées sur le champ des vites-
ses par :
V.A.1) l'incompressibilité du fluide,
V.A.2) la présence de la sphère,
V.A.3) la compatibilité avec l'approximation linéaire de l'équation locale de la
dynamique.
On donne le champ des vitesses suivant :
3
vr : V0cos6{l --Ë+E--3]
27' 27°
3R R3 -
ve : -- VOsin6(1--------3]
47° 47.
v