Mines Chimie PSI 2011
| Thème de l'épreuve | Le calcium et le magnésium |
| Principaux outils utilisés | atomistique, cristallographie, solutions aqueuses, cinétique chimique, thermochimie, diagrammes d'Ellingham |
| Mots clefs | calcium, magnésium, dents |
Corrigé
: 👈 gratuite pour tous les corrigés si tu crées un compte👈 l'accès aux indications de tous les corrigés ne coûte que 5 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)




Rapport du jury
(télécharger le PDF)

Énoncé obtenu par reconnaissance optique des caractères
A 2011 Chimie PSI
ECOLE DES PONTS PARISTECH,
SUPAERO (ISAE), ENSTA PARISTECH,
TELECOM PARISTECH, MINES PARISTECH,
MINES DE SAINT-ETIENNE, MINES DE NANCY,
TELECOM BRETAGNE, ENSAE PARISTECH (FILIERE MP)
ECOLE POLYTECHNIQUE (FILIERE TSI)
CONCOURS D'ADMISSION 2011
EPREUVE DE CHIMIE
Filière : PSI
Durée de l'épreuve : 1 heure 30 minutes
L'usage d'ordinateur ou de calculatrice est interdit
Sujet mis àla disposition des concours :
Cycle International, ENSTIM, TELECOM INT, TPE-EIVP.
Les candidats sont priés de mentionner de façon apparente sur la première page
de la copie :
CHIMIE 2011-Filière PSI
Cet énoncé comporte 8 pages de texte.
Si au cours de l'épreuve, un candidat repère ce qui lui semble être une erreur
d'énoncé, il est invité à le
signaler sur sa copie et à poursuivre sa composition en expliquant les raisons
des initiatives qu'il aura
été amené à prendre.
DEBUT DE L'ENONCE
| LE CALCIUM ET LE MAGNESIUM
Des données utiles pour la résolution du problème sont fournies à la fin de
l'énoncé.
A) structure électronique et structure cristallographique à l'état métallique.
1- Rappeler les règles générales permettant d'établir la configuration
électronique d'un
atome dans l'état fondamental et les appliquer à l'atome de calcium puis à
l'atome de
magnésium situé juste au-dessus dans la classification périodique.
2- Justifier la stabilité du degré d'oxydation +II pour ces éléments.
3- Comparer les pouvoirs réducteurs respectifs du calcium et du magnésium,
justifier.
Le calcium métallique cristallise sous deux types de structure. L'une est de
type cubique &
faces centrées, notée Caa et l'autre de type cubique centrée, notée Cafl.
4- Représenter la maille conventionnelle de ces deux types de structure.
Préciser la
coordinence et le nombre d'atomes par maille dans chaque cas.
Page 1/8 Tournez la page S.V.P.
Chimie 2011 -- Filière PSI
5- En expliquant le raisonnement, exprimer en fonction des données le rayon de
l'atome
de calcium dans la structure Ca,.
B) Le carbure de calcium et l'acétylène (éthyne).
Le carbure de calcium Can est un solide à partir duquel on peut produire
aisément de
l 'étbyne gazeux C 2H 2.
6- Proposer un réactif simple, courant et facile à utiliser, et écrire la
réaction
correspondante.
7- Expliquer l'intérêt de cette réaction pour les lampes à << acétylène >>
(=éthyne) qui ont
été utilisées par exemple en spéléologie.
8- Décrire la nature de la liaison chimique entre les atomes de carbone de
l'éthyne.
Préciser la géométrie de la molécule.
9- Ecrire la réaction de combustion complète de l'éthyne en posant le
coefficient
stoechiométrique de l'éthyne égal à 1 (tous les réactifs sont à l'état gazeux).
On étudie à présent la combustion d 'un mélange stoechiométrique air--étbyne.
Les gaz entrent
& la température T =298 K et à la pression P= 1,0 bar dans la flamme, on
considèrera que le
système évolue de manière adiabatique. On supposera que l'air est constitué à
20% de
dioxygène et 80% de diazote (proportions molaires}.
10- Exprimer en fonction des données l'enthalpie standard de la réaction de
combustion de
l'éthyne à 298 K, A,H°.... .
11- A l'aide d'un chemin thermodynamique qu'on explicitera, calculer la
température
Tñamme des gaz après combustion compléte sous pression constante de 1 bar
(température de
flamme).
C) Le calcium, constituant des dents. Physico-chimie bucco-dentaire.
L émail dentaire est composé à 95% d 'bydroxyapatite, solide ionique de formule
brute
Ca 10(PO4)6( OH) 2(,). Sa dissolution en solution aqueuse s 'écrit :
Calo(P04)6(0H)2w = 10 Ca2+(aq) + 5 P043'(aq) + 2 OH _(aq) (C1)
La constante d équilibre sera notée KS ;.
12- Proposer une structure de Lewis pour l'ion phosphate.
13- Calculer (avec une précision raisonnable) la solubilité s de
l'hydroxyapatite à 37°C
dans une solution de pH fixé à 7,2 ne contenant pas d'autres espèces de calcium
ni de
phosphate dans l'état initial.
La salive en contact avec l'émail dentaire étant constamment renouvelée, ce
dernier risque
/ . . \ / . / . . . 2+ 2--
tbeortquement de se dtssoudre peu a peu. En realtte la SdllVEUR conttent des
tons Ca et HPO4
dont on supposera les concentrations constantes :
[Ca2+]=[ HPOf'] = 2.104 mol.L'l
Page 2/ 8
Chimie 2011 -- Filière PSI
On considèrera tout d'abord que le pH salivaire est fixe : pH = 7,2
14- Déterminer le signe de l'affinité chimique de la réaction (Cl) dans ces
dernières
conditions. Conclure.
On considère a présent un pH variable et on suppose toujours:
[Ca2+]=[ HPOf'] = 2.104 mol.L'l .
15- Montrer qu'en dessous d'une certaine valeur de pH qu'on évaluera à une
demi--unité
près, il existe un risque de dissolution d'hydroxyapatite (déminéralisation,
première étape de
l'apparition de caries).
16- Montrer qu'au-dessus d'une certaine valeur de pH qu'on évaluera à une
demi--unité
près, il existe un risque de précipitation de Ca3(PO4)2(S) (participant à la
formation de << tartre >>
dentaire).
On considère que, pour un milieu salivaire normal, le pH doit être voisin de
7,2: il est donc
important que le pH de la salive puisse être régulé de manière efficace. La
partie suivante est
consacrée a l 'étude de cette régulation.
La dégradation des débris alimentaires, par les bactéries présentes dans la
salive, produit des
. + A . . .
tons H3O ; de meme, de nombreuses bozssons gazeuses (sodas, JMS de fruits...)
sont
relativement acides. Pour neutraliser très rapidement cette acidité, les
glandes salivaires
libèrent des ions HCO3- dans la salive (jusqu'à 6 10'2 mol.L'1) .
On adopte dans la suite les notations KOH pour désigner des constantes
d'équilibre
thermodynamique et kn pour des constantes cinétiques.
Il se produit alors les réactions suivantes :
(C2) HCO3-(aq)+H3O+(aq)=CO2(aq) +2H20(1) KO2=106,3
( C3) CO2(aq) = C02 (8) KO3
Cinétique de la réaction (C2)
On étudie, dans l'eau et a pH=7,2, la réaction directe de (C2) qu'on suppose
être un
processus élémentaire :
HCOg-(aq) + H3O+(aq) --> C02(CZQ) + 2H20(1) k2= 7 105 s'] mol] L
On suppose qu 'à pH = 7,2 , on peut négliger la réaction inverse.
17- Ecrire la loi de vitesse de la réaction. Expliquer pourquoi elle est
d'ordre 1 dans les
conditions expérimentales considérées. Evaluer le temps de demi-réaction
vis-à-vis de HCO{
(aq) dans une solution aqueuse dont le pH est fixé à 7,2. Quelle conclusion en
tirez-vous
quant à la régulation du pH salivaire ?
En fait, la salive contient une enzyme, l'anhydrase carbonique VI, qui augmente
considérablement les vitesses des réactions directes et inverses de (C2), on
peut alors
Page 3/8 Tournez la page S.V.P.
considérer que dans la salive, ces deux réactions sont quasi--instantanées et
que l'équilibre
thermodynamique est établi à tout moment pour la réaction ( C2).
Etude cinétique de [ 'anhydrase carbonique VI
Pour la réaction directe de (C2) catalysée par l 'anhydrase carbonique VI,
notée E--H20, on
propose le schéma cinétique simplifié suivant (toutes les espèces écrites dans
ces deux
mécanismes sont en solution aqueuse, dans un système qui évolue à T=310,15 K et
à volume
Vconstant. ) :
étape ] E--HZO +HCO3' --'> E--HCO3' + H20 k1
étape 2 E-HCO3' : E-OH' + CO2 équilibre rapide de constante K
étape 3 E-OH' +H3O+ : E--HZO + HZO équilibre rapide
Pour la réaction inverse de (C2) catalysée par l 'anhydrase carbonique VI, on
propose le
schéma cinétique simplifié suivant :
étape l' E-HZO + H2O # E-OH' +H3O+ équilibre rapide de constante Ka(E)
étape 2' E-OH' + 002 ; E--HCO3' équilibre rapide
étape 3' E-HCO3' +H2O _» E-}120 + HCO3' k'3
Pour la réaction directe, la vitesse de réaction v est définie comme la vitesse
de disparition
des ions HCO3 . Pour la réaction inverse, la vitesse de réaction v' est définie
comme la
vitesse d 'apparition des ions HCO3_ .
On note [E], = [E--H20] + [E-OH _] + [E-HCO37 la concentration totale en espèces
enzymatiques et Ka(E) la constante d'acidité de E--HgO
On observe expérimentalement que la concentration [E-HCO{ ] est négligeable
devant
[E--HgO] et [E--OH ' ].
18- Exprimer la loi de vitesse associée à V' et montrer qu'elle peut se mettre
sous la forme
--1
[H30+] ' _
v'= V'o x 1+ K (E) ou v'0 est fonction de K, [E]t , [C02 (aq)] et k'3 [H20].
19- Quelle est la relation entre V et V' à l'équilibre?
Chimie 2011 -- Filière PSI
20- Dans un milieu salivaire normal à l'équilibre (pHOE 7,2), on trouve V %
V'() /2. Evaluer
la constante Ka(E).
Le sorbitol, molécule présente dans les dentifrices.
Les dentifrices industriels contiennent diverses molécules organiques, dont le
sorbitol
représenté ci-apre's:
O
E
-ulllll G
E
H
3 . 6
OH OH
21- Proposer un nom pour le sorbitol en nomenclature systématique, sans
indication de
stéréochimie.
22- La molécule de sorbitol est-elle chirale ? Justifier. Comment le vérifier
expérimentalement ?
23- Déterminer le descripteur stéréochimique des atomes de carbone 2 et 3.
D) Le magnésium en métallurgie.
Le magnésium et le calcium sont utilisés dans l'élaboration de nombreux métaux
par
réduction des oxydes, chlorures ou fluorures de ces derniers. Dans le cas de
l'uranium, le
magnésium intervient enfin de processus selon la réaction :
%UF4 + Mg = %U+ MgF2 (DI)
L 'étude de ce type de réaction est similaire a celle de couples oxydes
métalliques/métal par
les diagrammes d'Ellingham. Le dioxygène Og(g) est juste remplacé par le
difluor F 2(g). Les
deux couples étudiés ici selon l'approximation d 'Ellingham sont alors UF 4/ U
et MgF 2/Mg.
24- Ecrire les équations de formation de UF4 et de MgFZ à partir respectivement
de U et
Mg en imposant un coefficient stoechiométrique égal à 1 pour F2(g).
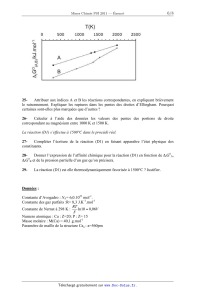
On représente dans la figure suivante les variations d 'enthalpie libre
standard de ces
réactions en fonction de la température. L 'axe des ordonnées est
volontairement non gradué,
et l'axe des abscisses le coupe a une valeur non précisée qui n 'est pas zéro.
Page 5/8 Tournez la page S.V.P.
Chimie 2011 -- Filière PSI
T(K)
D 500 1000 1500 2000 2500
E
E /l
_] ____J
E A
Æ /
5 r
Ü
@ 5
{il .:,
25- Attribuer aux indices A et B les réactions correspondantes, en expliquant
brièvement
le raisonnement. Expliquer les ruptures dans les pentes des droites
d'Ellingham. Pourquoi
certaines sont--elles plus marquées que d'autres ?
26- Calculer à l'aide des données les valeurs des pentes des portions de droite
correspondant au magnésium entre 1000 K et 1500 K.
La réaction (DI) S 'effectue & 1500°C dans le procédé réel.
27- Compléter l'écriture de la réaction (DI) en faisant apparaître l'état
physique des
constituants.
28- Donner l'expression de l'affinité chimique pour la réaction (D1) en
fonction de A,GOA,
A,G°B et de la pression partielle d'un gaz qu'on précisera.
29- La réaction (DI) est elle thermodynamiquement favorisée à 1500°C ?
Justifier.
Données :
Constante d'Avogadro : NA= 6,0.1023 mol"'.
Constante des gaz parfaits :R= 8,3 J.K".mol'1
Constante de Nernst à 298 K : %ln10 = 0,06V
Numero atomique : Ca : Z=20; P : Z= 15
Masse molaire : M(Ca) = 40,1 g.mol'1
Paramètre de maille de la structure Caa : a=560pm
Page 6/ 8
Chimie 2011 -- Filière PSI
Produit ionique de l'eau : à 310K, on prendra pKe = 14,0
pKa de couples acido-basiques à 310,15 K :
H3PO4/ H2PO4- pKa1 : 2,15
H2Po4'/ HPOf' pKa2 = 7,2
HPO42'/ Po43' pKa3 = 12,1
Constantes de solubilité à 310,15 K :
Hydroxyapatite Ca...(PO4)6(OH)2 (s)
Phosphate de calcium Ca3(PO4)2 (s)
sz1 = 117
pKS2 = 27
Données thermodynamiques :
Enthalpies standard de formation à 298 K et capacités calorifiques molaires
(supposées
indépendantes de la température) à pression constante :
CO2(g) H2O(g) C2H2(g) O2(g) N2(g)
AfH° /kJ.mol_1 -390 -240 230 0 0
CP /J°K_1 ° m0Ï1 40 40 40 30 30
Enthalpies standard de formation à 298 K, entropies standard à 298 K et
températures de
changement d'état :
F2(g) Mg(s) Mg(l) Mg(g) MgF2(s) MgF2(l)
AfHO/kJ.mol_l 0 0 9 146 -1124 -1066
s;;, /J.K"1moz--1 203 33 42 149 57 95
T,, /K - 922 1363 - 1536 >2000
%) U... UF4(s) UF4(D
AfHO/kJ.mol_l 0 16 -1921 -1874
s;;, /J.K"1.mor1 50 64 152 188
TçÛ "{ 1405 >2000 1309 >2000
T ,, représentant la température de fusion pour un solide, la température de
vaporisation pour
un liquide.
Page 7/8
Tournez la page S.V.P.
Approximations numériques: w/_æ 1--70 w/ë z%
FIN DE L'ENONCE