Mines Chimie PSI 2003
| Thème de l'épreuve | Chimie de l'élément chlore |
| Principaux outils utilisés | oxydo-réduction, diagrammes potentiel-pH, atomistique, polymérisation radicalaire |
| Mots clefs | électrolyse, pVC, eau de Javel |
Corrigé
: 👈 gratuite pour tous les corrigés si tu crées un compte👈 l'accès aux indications de tous les corrigés ne coûte que 5 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)


Rapport du jury
(télécharger le PDF)

Énoncé obtenu par reconnaissance optique des caractères
ECOLE NATIONALE DES PONTS ET CHAUSSEES.
ECOLES NATIONALES SUPERIEURES DE L'AERONAUTIQUÈ ET DE L'ESPACE,
DES TECHNIQUES AVANCEES, DES TELECOMMUNÏCATIONS,
DES MINES DE PARIS, DES MINES DE SAINT--ETIENNE, DES MINES DE NANCY,
DES TELECOMMUNÏCATIONS DE BRETAGNE.
ECOLE POLYTECHNIQUE ( Filière TSI ).
CONCOURS D'ADMISSION 2003
EPREUVE DE CHIMIE
Filière : PSI
Durée de l'épreuve : 1 heure 30 minutes
L'usage d'ordinateur ou de calculatrice est interdit
Sujet mis àla disposition des concours : Cycle International, EN STIM, TPE-EIVP.
Les candidats sont priés de mentionner de façon apparente sur la première page
de la copie :
CHIMIE 2003--Filière PSI
Cet énoncé comporte 6 pages de texte.
Si au cours de l'épreuve, un candidat repère ce qui lui semble être une erreur
d'énoncé, il le signale sur
sa copie et poursuit sa composition en expliquant les raisons des initiatives
qu'il est amené à prendre.
DEBUT DE L'ENONCE
LE CHLORE
Ce problème traite de différents aspects de la chimie du chlore. Toutes les
parties sont totalement
indépendantes. Aucune réponse non justifiée ne sera prise en compte.
1 Structure de la matière
1- Le chlore a pour numéro atomique Z = 17. A quoi correspond Z ? Donner la
structure électronique de l'atome
de chlore dans son état fondamental.
2- Donner la structure de Lewis ainsi que la géométrie des entités suivantes :
CIOJ, Clg, ClO{ , en précisant
dans chaque cas le nombre d'oxydation (degré d'oxydation) du chlore.
3-- Les énergies de première ionisation EI, (en kJ.mol"') des éléments de la
ligne du chlore sont les suivantes :
...
Définir l'énergie de première ionisation pour un atome. Justifier l'évolution
générale de ces valeurs et
discuter les anomalies apparentes.
. 4- La plus grande source de chlore est constituée par le chlorure de sodium
présent dans l'eau de mer. Quelle est
la solubilité dans l'eau pure à 20°C du chlorure de sodium : 3,6 g.L"l, 36
g.L", 360 g.L'l ou 3600 g.L"l ?
5- Après évaporation de l'eau on obtient du chlorure de sodium solide.
Représenter la maille conventionnelle du
réseau cristallin de NaCl. Quelle en est la multiplicité ? Quelle est la
coordinence des ions ?
Il Préparation du dichlore : électrolyse d'une solution aqueuse de chlorure
de sodium
Le dichlore est produit par électrolyse d'une solution aqueuse concentrée de
chlorure de sodium (la saumure).
Celle--ci doit être traitée préalablement à l'aide de carbonate ou de chlorure
de baryum afin d'éliminer les ions
sulfates, puis à l'aide de soude et de carbonate de sodium pour éliminer les
ions calcium, magnésium et autres
ions métalliques gênants.
Il existe différents procédés :
- cellules à diaphragmes, non étudiées dans ce problème,
- cellules à membranes,
-- cellules à cathode de mercure.
Données:
Potentiels standard E° à 25°C et à pH= 0
E°(02/H20)-- -- 1 ,23 V
E°(Cl2/Cl =1,39 V
E°(H+/H2) : 0,00 V
E°(Na'/Na) : --2,71 V.
A- Etude préliminaire
6- D'après les valeurs des potentiels standard, quelles sont les
demi--équations d'oxydoréduction possibles à
l'anode ? à la cathode ?
7 - A quelle réaction d'oxydoréduction pourrait--on s'attendre au cours de
l'électrolyse en l'absence de surtension
au niveau des électrodes ? Calculer la constante d'équilibre de cette réaction.
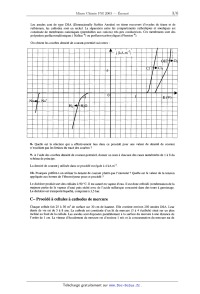
B- Procédé à cellules à membrane
Un schéma de principe d'une cellule à membrane, à compléter, est représenté
ci--après :
1
' T
.
*-- g ---->
saumure diluée vers ÿ " â _}
COUCCnU3UOH ?, vers circuit de
? concentration
- %
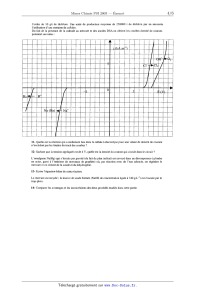
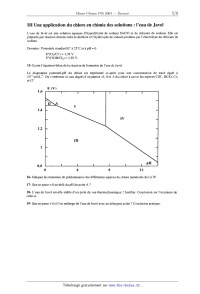
saumure _» <_ H7_O saturée membrane Les anodes sont de type DSA (Dimensionally Stables Anodes) en titane recouvert d'oxydes de titane et de ruthénium, les cathodes sont en nickel. La séparation entre les compartiments cathodiques et anodiques est constituée de membranes cationiques (splitéables aux cations) très peu conductrices. Ces membranes sont des polymères perfluorosulfoniques ( Nation @) ou perfluorocarb0xyliques (Flemion ®). On obtient les courbes densité de courant--potentiel suivantes : Il......llllllll WMfi Il...-m- ------.---------- l'un--nu- IIIIIIIIIIIIIIIIIl......fllflflfi ---------I-IIIIIl'...-IJQI-m- Il......lllll'lflIllllllämflll' III....IIIIIIIIÜIIIIIIIIIIHII --I------I-------------l-Im-- II....IIIIII.IIIIII..IIflIflIII -----------------------n-u--- ...--------I----...--...un...-- .IÏII---II-lfll--Ifl III.HIIIIIÆHÙ "H&M-I-I-IH-I-I- ......IIIIËÜI .Il-I'l-Iflfllflffl-III III-Il......- IIIIIIIIIÜIIÙIIIII IIII-----I-II IHIIIIIIIIIIIIIII ------------- ......IIIVIIIIIII...---------- --------..------ ---------I-II --------Il---II-- III.-III....- ---------------- I......I'II.' ......'I'I'IIIII --------I--II 8- Quelle est la réaction qui a effectivement lieu dans ce procédé pour une valeur de densité de courant n'excédant pas les limites du tracé des courbes ? 9- A l'aide des courbes densité de courant--potentiel, donner un nom à chacune des cases numérotées de 1 à 8 du schéma de principe. La densité de courant j utilisée dans ce procédé est égale à 4 kA.m"2. 10- Pourquoi préfère--t--on utiliser la densité de courant plutôt que l'intensité '? Quelle est la valeur de la tension appliquée aux bornes de l'électrolyseur pour ce procédé ? Le dichlore produit sort des cellules à 90 °C. Il est saturé en vapeur d'eau. Il est donc refroidi (condensation de la majeure partie de la vapeur d'eau) puis séché avec de l'acide sulfurique concentré dans des tours à garnissage. Le dichlore est transporté liquéfié, comprimé à 3,5 bar. C---- Procédé à cellules à cathodes de mercure Chaque cellule fait 25 à 30 m2 de surface sur 30 cm de hauteur. Elle contient environ 250 anodes DSA. Leur durée de vie est de 5 à 8 ans. La cathode est constituée d'un lit de mercure (3 à 4 t/cellule) situé sur un plan incliné au fond de la cellule. Les anodes sont disposées parallèlement à la surface du mercure à une distance de l'ordre de 1 cm. La vitesse d'écoulement du mercure est d'environ 1 m/s et la consommation du mercure est de l'ordre de 10 g/t de dichlore. Une unité de production moyenne de 250000 t de dichlore par an nécessite l'utilisation d'une centaine de cellules. Du fait de la présence de la cathode au mercure et des anodes DSA on obtient les courbes densité de courant- potentiel suivantes : IIIIIIIIIIIIIIIIIIIllllllll'lfll IIIIIIIIIIIIIIIIIIIflflflllllflllfll IIIIIIIIIIIIIIIIIIIl...'llflllfll Il....llllll'l'l'lIl..llllfl!flflfl Il.llllllllllllllflIII-III-fl-flflfl IIIIIIIIIIIIIIIIIIIlllllläfiëfll' Illlllllllll'l'l'lIIIIIIIIIIIII IIIIIIIIIIIIIIIIIIIl...'lfllfllll Il.lllllllllllllllIl....lfllfll'l Il..llllllllllllllIIIIIIIHMIIII Ilfilllllfll'llfll'lflIl..llllllflflfl &&!äIIIIHIIIIIIIIIIl...'llll'll I"IIIIIIÆIIIIIIIIIIl..lllllllll IflllllllllllllllllIIIIIIIIIIIII filllfiflääfiflllllllllIl....llllll' Il..lllflllllllllllIl..lllllllll Il....."ll'l'l'l'.IIIIIIIIIIIII III....HIIIII'I'I'Il..lllll'lll IIIIIIIÜIIIIIIIIIIIIIIIIIIIIIII IIIIIIlIIIIIIIIIIIIIIIIIIIIIIII 11- Quelle est la réaction qui a réellement lieu dans la cellule à électrolyse pour une valeur de densité de courant n'excédant pas les limites du tracé des courbes ? 12- Sachant que la tension appliquée est de 4 V, quelle est la densité du courant qui circule dans le circuit ? L'amalgame Na(Hg) qui s'écoule par gravité (du fait du plan incliné) est envoyé dans un décomposeur (cylindre en acier, garni à l'intérieur de morceaux de graphite) où, par réaction avec de l'eau adoucie, on régénère le mercure et on obtient de la soude et du dihydrogène. 13- Ecrire l'équation--bilan de cette réaction. Le mercure est recyclé ; la lessive de soude formée (NaOH de concentration égale à 740 g.L"l) est évacuée par le trop--plein. 14- Comparer les avantages et les inconvénients des deux procédés étudiés dans cette partie. 111 Une application du chlore en chimie des solutions : l'eau de J avel L'eau de Javel est une solution aqueuse d'hypochlorite de sodium NaClO et de chlorure de sodium. Elle est préparée par réaction directe entre le dichlore et l'hydroxyde de sodium produits par l'électrolyse du chlorure de sodium. Données : Potentiels standard E° à 25 °C et à pH : 0 E°(CldCl" : 1,39 V E°(ClOH/Cb) : 1,59 V. 15- Ecrire l'équation--bilan de la réaction de formation de l'eau de Javel. Le diagramme potentiel--pH du chlore est représenté ci--après pour une concentration de tracé égale à 10°2 mol.L". On s'intéresse ici aux degrés d'oxydation +1, 0 et ----I du chlore à savoir les espèces CIO", HClO, C12 et C1". E (V) 1,6 1,4 IV 1,2 111 1 H 0,8 p 0 4 8 12 16- Indiquer les domaines de prédominance des différentes espèces du chlore numérotés de I à IV. 17-- Que se passe--t--il au-delà du pH du point A ? 18- L'eau de lave] est--elle stable d'un point de vue thermodynamique '? Justifier. Conclusion sur l'existence de celle--ci. 19- Que se passe--t--il si l'on mélange de l'eau de Javel avec un détergent acide ? Conclusion pratique. IV Une application du dichlore en chimie organique : le polychlorure de vinyle A --- Synthèse du chlorure de vinyle (ou chloroéthène) Une des plus importantes applications de la fabrication du dichlore est son utilisation dans la synthèse du chlorure de vinyle puisqu'elle représente 25% de son utilisation. Sa production mondiale est de l'ordre de 20 millions de tonnes par an. La première étape consiste à effectuer la chloration de l'éthylène (éthène). 20- Ecrire l'équation-bilan de la réaction (réaction (l)) ainsi que son mécanisme en supposant qu'il s'agit du même que celui de la bromation de l'éthylène. Quel est le nom de la molécule A obtenue ? Que peut-on dire sur l'aspect stéréochimique de ce type de réaction ? En fait, cette étape est effectuée en phase liquide à 60°C en présence d'un catalyseur qui augmente la sélectivité. La seconde étape consiste à éliminer HCl du composé A à 500°C sous une pression de 12 bar, par un mécanisme , radicalaire, pour obtenir le chlorure de vinyle. 21- Ecrire l'équation--bilan de cette réaction (réaction (2)). Dans la synthèse industrielle, il y a une troisième réaction d'oxychloration dont l'équation--bilan est : CH2=CH2 + 2 HC] + 1/2 02 "à CH2C1--CHzCI + H20. (3) Elle a pour but d'utiliser le chlorure d'hydrogène fabriqué dans la seconde étape de la synthèse du chlorure de vinyle. Cette réaction est effectuée à 230°C sous une pression de 5 bar avec comme catalyseur le chlorure cuivrique déposé sur alumine. On a donc le bilan global : 2 CH2=CH2 + C12 + 1/z 02 9 2 CH2=CHCI + H20. (4) B -- Synthèse du polychlorure de vinyle Le chlorure de vinyle est utilisé comme monomère pour la synthèse du polychlorure de vinyle. 22- Donner le mécanisme radicalaire de la polymérisation de chlorure de vinyle en supposant que c'est le même que celui du styrène. L'amorceur radicalaire utilisé est le peroxyde de dibenzoyle représenté ci-dessous. 0 0 peroxyde de di benzoyle 0--0 23- Quels sont les types de stéréorégularité que l'on observe dans les polymères ? Les illustrer sur l'exemple du polychlorure de vinyle. 24- Quel symbole est utilisé pour le polychlorure de vinyle '? Citer quelques applications de ce polymère. FIN DE L'ENONCE.