X Chimie PC 2009
| Thème de l'épreuve | Synthèse et propriétes d'un hydrocarbure polyénique. Aromatique ou non aromatique? Le cuivre: affinage, corrosion en milieu ammoniacal et complexes de Cu(II)-oligopeptides. |
| Principaux outils utilisés | chimie organique, théorie de Hückel, oxydoréduction, courbes intensité-potentiel, solutions aqueuses |
| Mots clefs | polyène, électrolyse à anode soluble, déterminant séculaire, théorie de Huckel, réaction de Mannich, Diels Alder, voltamogramme |
Corrigé
: 👈 gratuite pour tous les corrigés si tu crées un compte👈 l'accès aux indications de tous les corrigés ne coûte que 5 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)









Rapport du jury
(télécharger le PDF)





Énoncé obtenu par reconnaissance optique des caractères
ÉCOLE POLYTECHNIQUE
ÉCOLE SUPÉRIEURE DE PHYSIQUE ET DE CHIMIE INDUSTRIELLES
CONCOURS D'ADMISSION 2009
FILIÈRE
PC
COMPOSITION DE CHIMIE
(Durée : 4 heures)
L'utilisation des calculatrices n'est pas autorisée.
L'épreuve comporte deux problèmes indépendants.
Premier problème
Synthèse et propriétés d'un hydrocarbure polyénique.
Aromatique ou non aromatique ?
Données
La spectroscopie ultraviolette (U.V.) utilise des radiations électromagnétiques
dans la zone
des longueurs d'onde s'étendant de 200 à 400 nm. Elle est particulièrement
utile pour l'étude
des structures électroniques de molécules insaturées, notamment des systèmes
polyéniques. Pour
ceux-ci, l'absorption d'un photon d'énergie h entraîne le passage d'un électron
de la plus haute
orbitale occupée (HO) vers la basse orbitale vacante (BV) ; le pic principal
correspondant dans
le spectre électronique est alors observé à la longueur d'onde max = c/.
Absorptions U.V. (en nm) de quelques oléfines :
Molécule
Penta-1,4-diène
Z -Penta-1,3-diène
Z -Hexa-1,3,5-triène
max
178
213
268
Résultats des calculs de Hückel sur le prop-2-énal et l'hydroxyéthène :
Le substituant hydroxyle est décrit dans ces calculs comme un hétéroatome à
deux électrons
défini par les paramètres OH = + 2 et C-OH = 0, 7. L'atome d'oxygène est
défini par les
paramètres O = + et CO = . On rappelle que est une grandeur négative.
Énergies et coefficients des orbitales moléculaires du prop-2-énal :
2
O
3
1
1
E
+ 1, 88
O
0,657
0,577
0,429
0,228
C1
0,577
0,000
- 0,577
- 0,577
C2
0,429
- 0,577
- 0,228
0,657
C3
0,228
- 0,577
0,657
- 0,429
+
- 0, 35
- 1, 53
Énergies et coefficients des orbitales moléculaires de l'hydroxyéthène :
OH
1
2
E
+ 2, 34
+ 0, 77
- 1, 11
O
0,910
0,370
0,188
C1
0,382
-0,568
-0,729
C2
0,163
-0,735
0,658
Produit de solubilité à 298 K :
AgI(s) Ag+ + I-
Ks = 10-16
Le composé étudié que l'on notera A est un hydrocarbure polyénique qui
appartient à la
famille des annulènes. C'est un liquide légèrement jaune existant à l'état
naturel, puisqu'il a
été identifié comme étant une des molécules responsables de l'odeur des
tomates. De nombreuses
études ont permis de mieux comprendre ses propriétés particulières. Sa première
synthèse a utilisé
comme précurseur la pseudo-pelletiérine, un alcaloïde naturel présent dans
l'écorce de grenadier.
1. Détermination de la structure de A
1.1 A, de formule brute (CH)n , conduit par hydrogénation catalytique au
cyclooctane.
Lorsque A est ozonolysé en milieu réducteur en présence de diméthylsulfure, un
seul produit
est isolé, le glyoxal, de formule brute C2 H2 O2 .
a) Représenter une structure pour A compatible avec ces observations, en
justifiant, puis
nommer A en accord avec la nomenclature IUPAC.
b) Écrire l'équation-bilan de l'étape d'ozonolyse de A, sachant que le
diméthylsulfure est
oxydé en diméthylsulfoxyde, (CH3 )2 SO.
c) Écrire la représentation de Lewis la plus probable pour le
diméthylsulfoxyde, en indiquant
les charges formelles éventuelles. En déduire la géométrie prédite par la
méthode VSEPR autour
de l'atome de soufre central.
d) Le composé A est-il aromatique ? Justifier.
2
1.2 Les déplacements chimiques (ppm) en RMN des protons du benzène, de A, ainsi
que
ceux des groupes CH3 du 2-phényl-propan-2-ol, et de A substitué par le fragment
-C(CH3 )2 OH
ont les valeurs suivantes :
H 7,20
(s,6H)
A : 5,76
(s,8H)
C(CH3)2OH
A
1,54
(s,6H)
s : singulet
C(CH3)2OH
1,16 (s,3H)
1,20 (s,3H)
a) Quelles informations peut-on déduire de la comparaison de ces valeurs ? On
indique que
les protons de l'éthène sont observés à 5,33 ppm.
b) Conclure quant à une géométrie pour la molécule A qui soit compatible avec
ces informations.
1.3 Soient i =
8
P
Cik i , {i = 1 à 8}, les huit fonctions d'onde monoélectroniques normées
k=1
(orbitales) décrivant le système de la molécule A.
a) Écrire le déterminant séculaire D associé au système de A dans
l'approximation de
-E
.
Hückel. On posera x =
b) La factorisation de ce déterminant aboutit à l'expression : D = x2 (x2 -
4)(x2 - 2)2 .
En déduire le diagramme énergétique des orbitales moléculaires du système de
A, puis la
configuration électronique de A dans son état fondamental. La molécule est-elle
paramagnétique ?
c) Calculer l'énergie du système de A, puis évaluer son énergie de résonance
Er , définie
comme la différence d'énergie du système du système conjugué et du système non
conjugué.
Comparer le résultat à la valeur Er = 2 calculée pour le benzène.
d) Les enthalpies d'hydrogénation complète r H mesurées pour différentes
molécules insaturées cycliques sont indiquées dans le tableau ci-dessous :
Molécule
Cyclohexène
Benzène
Cis-Cyclooctène
A
r H (kJ/mol)
119,7
208,5
96,3
410,3
Ces valeurs sont-elles en accord avec le résultat du calcul 1.3.c) précédent ?
Quelle hypothèse
convient-il de réviser ?
3
2. Synthèse de A
2.1 La pseudo-pelletiérine, notée B, possède la structure
donnée ci-contre. Traitée par LiAlH4 dans le tétrahydrofurane anhydre, elle
donne naissance à deux composé C et C ,
qui sont ensuite chauffés dans un mélange d'acides acétique
et sulfurique pour fournir D, de formule brute C9 H15 N.
O
N
B
a) Donner une représentation spatiale de B dans sa conformation la plus stable,
en justifiant.
Est-elle chirale ? Indiquer la configuration absolue de ses carbones
asymétriques éventuels.
b) Quelles sont les structures de C et C ? Présentent-ils une activité optique
? Peut-on les
séparer ?
c) Rappeler le mécanisme de la réaction conduisant à D, dont on précisera la
formule semidéveloppée. D est-il optiquement actif ? Justifier.
2.2 Le composé D est soumis à une séquence d'élimination selon Hofmann,
séquence dont le
principe est détaillé ci-après.
D est tout d'abord chauffé avec un excès d'iodométhane
pour donner le sel (composé ionique) E. Ce sel dissous dans
l'eau est ensuite chauffé modérément en présence d'un léger excès d'hydroxyde
d'argent(I) fraîchement préparé, ce
qui conduit après isolement à un second sel F (de formule brute C10 H19 NO)
dans lequel l'anion hydroxyde OH-
a remplacé l'anion de E. On observe également à ce stade la
précipitation d'un sel d'argent(I). F est alors porté à 110 C
sous pression réduite, pour donner après un traitement approprié un mélange de
deux diènes isomères G et H, dont
l'un des deux est représenté ci-contre.
(H3C)2N
G
Le spectre U.V. de ce mélange indique un maximum d'absorption à 220 nm.
a) Quel type de réaction se produit-il lorsque D est traité par l'iodométhane
en excès ?
Identifier le sel E alors obtenu.
b) Écrire l'équation bilan conduisant au sel F. Quel est le moteur de cette
réaction ?
c) Proposer un mécanisme bimoléculaire permettant d'expliquer la formation de G
à partir
de F. En déduire la structure de H également formé par ce mécanisme. Quel autre
isomère G
de G et H aurait-on pu également obtenir ? Pourquoi G est-il moins stable que G
et H ? Quelle
donnée confirme la formation majoritaire du couple G-H ?
2.3 La même séquence d'élimination selon Hofmann (méthylation, action de AgOH,
puis
chauffage) conduite avec le mélange G-H précédent permet d'isoler un seul
hydrocarbure I, dont
le spectre d'absorption U.V. présente clairement un seul maximum à 265 nm. On
indique qu'à
la fin de cette séquence, on récupère également de l'eau et une amine tertiaire
à faible point
d'ébullition.
4
a) Écrire les composés intermédiairement formés au cours de cette suite de
réactions, puis
proposer une structure pour I.
b) Quel autre isomère I de I pourrait-il se former ?
2.4 Dans l'étape suivante, une quantité équimoléculaire de dibrome est ajoutée
à une solution
de I dans le chloroforme à 20 C. Il n'est pas observé de formation de bromure
d'hydrogène, et
le produit J isolé après évaporation du solvant est le
dibromo-5,8-cycloocta-1,3-diène.
a) Rappeler le mécanisme de l'action du dibrome sur un alcène en prenant comme
exemple
le cyclooctène.
b) Représenter la structure de J réellement isolé, ainsi qu'un mécanisme
expliquant
sa formation.
c) Proposer une suite de réactions permettant de transformer J en polyène A.
Donner les
réactifs et les conditions opératoires utilisés.
3. Synthèse de la pseudo-pelletiérine B
3.1 La pseudo-pelletiérine utilisée pour la synthèse de A est en réalité
préparée grâce à une
réaction originale découverte par le chimiste Mannich. Cette réaction
multicomposant met en jeu
trois réactifs qui sont chacun un fragment du produit obtenu. Un de ces
réactifs, noté K, peut
facilement être obtenu en deux étapes.
Pour cela, un mélange équimoléculaire de prop-2-énal (C3 H4 O) et
d'éthoxyéthène (C4 H8 O)
est chauffé sous pression pendant 12 h à 140 C. Ceci permet d'engendrer avec un
rendement de
84% un composé hétérocyclique liquide L de formule brute C7 H12 O2 . L
vigoureusement agité
avec une solution molaire d'acide chlorhydrique fournit le produit désiré K.
a) Donner le nom et le mécanisme de la réaction conduisant à L, sachant qu'un
des réactifs
se comporte comme un diène. Identifier tous les isomères pouvant être obtenus.
b) Les orbitales moléculaires obtenues par un calcul de Hückel sur le
prop-2-énal et sur
l'éthoxyéthène modélisé par l'hydroxyéthène sont données en début du problème.
Préciser les
orbitales frontières du prop-2-énal et de l'hydroxyéthène. En déduire
l'interaction frontalière
favorisée entre ces deux molécules, puis le composé L qui sera majoritairement
obtenu ci-dessus.
On admettra que la première liaison qui se forme entre les deux composés
résulte de l'interaction
entre les sites ayant le plus gros coefficient dans les orbitales frontières.
c) Il se forme au cours de la condensation une faible proportion
d'un produit dont la formule semi-développée est donnée ci-contre.
Expliquer sa formation. Pouvait-on s'attendre à ce qu'il soit minoritaire ?
d) Détailler le mécanisme de formation de K à partir de L, et
nommer K.
5
O
CHO
e) Un exemple simplifié de la réaction de Mannich est illustré ci-après :
O
O
O
chauffage
+
+
H
H
R
R
R'
N
R'
H
N
- H2O
R= substituant alkyle, R'=substituant alkyle ou hydrogène
Quel(s) autre(s) réactif(s) organique(s) simple(s) faut-il utiliser pour
préparer B à partir de
K en utilisant la réaction de Mannich ? Résumer schématiquement les étapes
éventuelles. On
pourra imaginer une retrosynthèse possible de B à partir de K.
3.2 Par réaction avec deux équivalents de potassium dans l'éthoxyéthane
anhydre, A engendre
un sel M, de formule brute C8 H8 K2 .
a) Indiquer la nature de la réaction qui se produit lors de la formation de M,
puis dessiner
la structure de M en utilisant la représentation la plus appropriée.
b) Donner la configuration électronique de la partie « organique » du sel M
dans le cadre de
l'approximation de Hückel, puis calculer la valeur de l'énergie de résonance
correspondante.
c) Ce composé est-il aromatique ? Conclure sur la géométrie attendue de cette
espèce.
3.3 Chauffé avec l'anhydride maléique (anhydride de l'acide
cis-but-2-én-dioïque) A peut
facilement conduire par cyclo-addition [4 + 2] au produit représenté ci-après :
H
H
O
O
H
H
N
O
N est-il le produit prévu ? Montrer que l'obtention de N implique l'existence
d'un équilibre
entre A et un composé bicyclique O, dont la structure sera précisée. Ce
résultat est-il compatible
avec les conclusions formulées en 1.2.b) ?
Fin du premier problème
6
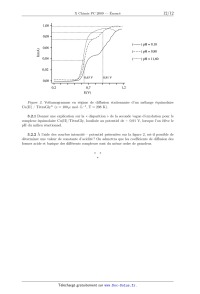
Deuxième problème
Le cuivre : affinage, corrosion en milieu ammoniacal
et complexes Cu(II) · oligopeptide.
Le cuivre pourrait bien être le premier métal à avoir été utilisé par l'homme,
étant donné
que des objets en cuivre datant de 8700 avant J.-C. ont été trouvés.
Traditionnellement, on situe
l'âge du cuivre au Chalcolithique, c'est-à-dire entre 2 300 et 1 800 av. J.-C.
Dans l'Antiquité le
cuivre était principalement extrait dans l'île de Chypre. Le « métal de Chypre
» était nommé aes
cyprium, puis cuprum. C'est là l'origine du mot cuivre.
Données
Données sur l'élément cuivre
M(Cu) = 63, 5 g · mol-1
Constantes d'équilibre (T = 298 K)
2-
-
pKa (H2 SO4 /HSO-
4 ) < 0 et pKa (HSO4 /SO4 ) = 1,9 pKa de Gly : 2,30 et 9,60 pKs (Cu(OH)2 ) = 20 pKs (CuS) = 36 pKd (Cu(NH3 )2+ 4 ) = 12 Données électrochimiques 2, 3RT F 0, 06 V 1 F = 96485 105 C · mol-1 E o (O2 /H2 O) = +1, 23 V E o (H+ /H2 ) = 0,00 V E o (Cu2+ /Cu) = + 0,34 V (couple rapide sur Cu) E o (Ag+ /Ag) = + 0,80 V (couple rapide sur Ag) E o (Zn2+ /Zn) = -0,76 V (couple rapide sur Zn) Potentiel de la réduction de l'oxygène dissous sur électrode de Cu vers + 0,25 V Potentiel de l'oxydation du Cu en milieu ammoniacal vers + 0,07 V Conductivités ioniques limites dans l'eau à 298 K 2 -1 ; o (H+ ) = 35,0 mS·m2 ·mol-1 ; o (OH- ) = 19,8 mS·m2 ·mol-1 ; o (SO2- 4 ) = 8,0 mS·m ·mol - o 2 -1 o 2+ 2 -1 (HSO4 ) = 5,0 mS·m ·mol ; (Cu) = 5,7 mS·m ·mol . Notations : - OOCCH + 2 -NHCOCH2 -NHCO-CH2 -NHCOCH2 -NH3 aussi être noté LH ; - OOCCH -NH+ Gly± pouvant également être noté LH. 2 3 7 TétraGly± qui pourra On rappelle que l'intensité par unité de surface d'électrode (la densité de courant) est proportionnelle à la vitesse des réactions électrochimiques mises en jeu et que, par convention, elle est positive pour les réactions d'oxydation se produisant à l'anode et négative pour les réactions de réduction se produisant à la cathode. On rappelle également que, dans le cas du tracé de courbes intensité-potentiel à une électrode indicatrice, l'échange d'électrons n'affecte les concentrations des espèces en solution qu'au voisinage immédiat de l'électrode, de telle sorte que les concentrations restent identiques aux concentrations introduites en solution homogène. C'est à cette condition que les tracés peuvent être utilisés à des fins de prévision des phénomènes d'électrolyse ou de corrosion. Un palier ou vague de diffusion est observé en utilisant une électrode tournante et tombante (régime stationnaire), ou en agitant le milieu de manière homogène avec un barreau aimanté (régime pseudo-stationnaire). Dans ce cas, la hauteur du palier est directement proportionnelle à la concentration en solution de l'espèce qui s'oxyde ou se réduit à l'électrode, à la surface de l'électrode et au nombre d'électrons échangés. 1. Affinage du cuivre Électrolyse à anode soluble La purification des métaux par électrolyse est possible grâce à l'emploi d'une anode soluble constituée de cuivre impur. La cathode de départ est initialement formée de feuilles minces de Cu raffiné. La solution électrolytique contient des ions cuivre(II)(aq), des ions sulfate SO2- 4 (aq) et de l'acide sulfurique H2 SO4 . 1.1 Donner un schéma du montage en indiquant : le sens du courant dans le circuit électrique, le sens de déplacement des électrons dans les conducteurs électriques, le sens de déplacement des ions cuivre(II) dans la solution électrolytique. 1.2 Écrire les équations des transformations qui se déroulent aux électrodes ainsi que la réaction d'oxydoréduction globale qui se déroule dans l'électrolyseur. 1.3 Pourquoi cette électrolyse peut-elle être qualifiée électrolyse à « anode soluble » ? 1.4 Expliquer qualitativement pourquoi on ajoute de l'acide sulfurique en plus d'une solution de sulfate de cuivre dans la solution électrolytique. 1.5 Tracer qualitativement la courbe intensité-potentiel en supposant que le couple Cu2+ /Cu est rapide sur Cu. Commenter la tension appliquée (0,4 V) aux bornes des deux électrodes en liaison avec la vitesse de déposition du cuivre. 1.6 Lors de l'électrolyse à courant imposé, donner l'expression de l'intensité de courant I qu'il convient d'appliquer pour dissoudre une anode de masse m avec une teneur en Cu de 98% en 30 jours. Pour m = 350 kg, on trouve I 400 A. Commenter ce résultat par rapport à l'électrolyse à potentiel contrôlé. 1.7 Quel est le risque de pratiquer l'électrolyse à intensité constante dans le cas où le cuivre contient des impuretés du type argent ou zinc ? 8 1.8 Expliquer le principe de purification sachant que l'argent est moins facile à oxyder que le zinc et expliciter le devenir des deux impuretés envisagées. 1.9 La concentration en ions cuivre(II) de la solution électrolytique varie-t-elle au cours du temps ? Justifier l'évolution de la concentration en ions cuivre(II) au sein de la solution à l'aide des courbes intensité potentiel. 2. Corrosion du cuivre en milieu ammoniacal L'étude ci-dessous se limite aux milieux neutres et légèrement basiques. En milieu ammoniacal et sur une électrode de cuivre, l'oxygène dissout est réduit suivant la réaction électrochimique : O2 + 2H2 O + 4e- 4OH- (couple lent sur électrode de cuivre) On supposera que le potentiel de cette réduction est peu décalé, pour des raisons cinétiques, quand le pH varie des milieux neutres vers les milieux ammoniacaux, et qu'il est voisin de + 0,25 V. Dans les conditions de l'expérience à 25 C et sous la pression atmosphérique, la solution contient 3.10-4 mol·L-1 d'oxygène dissout. On suppose que les constantes de diffusion du Cu2+ et Cu(NH3 )2+ 4 sont du même ordre de grandeur. On prendra une concentration de NH3 de 0,1 mol·L-1 . 2.1 En admettant que la corrosion est notable dès que la concentration en ions cuivre(II) est de l'ordre de 10-8 mol · L-1 , déterminer le pH de début de précipitation de Cu(OH)2 (s) en milieu non complexant, ainsi que celui en présence d'une concentration de 0, 1 mol · L-1 en NH3 . 2.2 Écrire la réaction d'oxydation anodique d'une électrode de cuivre plongeant dans une solution neutre ainsi que la réaction d'oxydation de la même électrode plongeant dans une solution d'ammoniac. 2.3 Déterminer le potentiel standard apparent relatif au couple Cu(NH3 )2+ 4 /Cu en milieu NH3 0,1 mol·L-1 . 2.4 Tracer sur une même figure l'allure des courbes i = f (E) d'oxydation attendue de Cu seul, de Cu en milieu NH3 0,1 mol·L-1 , ainsi que la courbe de réduction de l'oxygène dissout. Expliquer la présence ou l'absence de palier. 2.5 Montrer que l'oxygène dissout ne peut pratiquement oxyder le cuivre qu'en milieu ammoniacal. 2.6 Écrire la réaction chimique d'oxydation du cuivre par l'oxygène en milieu ammoniacal où [NH3 ]=0,1 mol·L-1 et indiquer le facteur qui limite la vitesse de cette réaction à température et pression constantes. 3. Complexation du Cu(II) avec des polypeptides Du fait du rôle important de systèmes biologiques à base de cuivre, l'étude de complexes formés avec des oligopeptides peut donner une contribution significative à la compréhension du comportement de protéines à base de cuivre(II). Les oligoglycines (diglycine, triglycine, tétraglycine, etc . . . ) sont d'excellents modèles de fragments de protéine permettant de mimer un enchaînement d'acides aminés de la protéine. 9 3.1 Complexation de l'ion Cu2+ avec les oligopeptides suivie par spectroscopie d'absorption UV-visible La complexation de l'ion Cu(II) avec des oligopeptides dans la solution aqueuse peut être suivie par spectroscopie d'absorption UV-visible. L'analyse des résultats permet de déterminer les modes de coordination de l'oligopeptide à différents pH. Les oligopetides contiennent plusieurs sites coordinants (bases de Lewis) qui peuvent servir à complexer l'ion Cu(II) : l'azote N -terminal du groupement amine (NH2 ), le groupement carboxylate (COO- ), le groupe amide (CONH- ) via l'oxygène du carbonyl ou l'azote de l'amide déprotoné (N- ). 3.1.1 Les couleurs des complexes entre l'ion cuivre (II) et la tétraglycine changent lorsque l'on élève le pH de la solution. Le complexe [CuL]+ correspond au complexe formé à partir de Cu2+ et la forme « dibase » de l'oligopeptide (L- dans le cas de TétraGly)·[CuHL]2+ , [CuLH-1 ] , [CuLH-2 ]- et [CuLH-3 ]2- correspondent quant à eux à des formes protonées et déprotonées de ce complexe respectivement. On supposera la formation d'un complexe octaédrique allongé où les positions axiales sont occupées par deux molécules d'eau. On pourra donc assimiler le système Cu(II) Tétragly à un complexe du type plan carré. Figure 1. Spectres d'absorption UV-visible en milieu aqueux en présence d'une quantité équimolaire d'ion Cu(II) et TétraGly (c = 5.10-3 mol · L-1 ). (a) pH = 5, 4 ; spectre de [CuL]+ . (b) pH = 6, 4 ; spectre de [CuLH-1 ]. (c) pH = 8, 0 ; spectre de [CuLH-2 ]- . (d) pH = 11,0 ; spectre de [CuLH-3 ]2- . Représentation des complexes, présents en quantité prépondérante, aux différents pH d'étude. Les deux molécules d'eau, faiblement coordinées en position axiale sont omises pour plus de clarté. 10 Les spectres UVvisible enregistrés pour le système Cu(II)TétraGly pour différents pH en milieu aqueux en présence d'une quantité équimolaire (c = 5.10-3 mol · L-1 ) d'ions Cu(II) et de TétraGly sont donnés figure 1. Déduire, à partir des spectres d'absorption (figure 1), en justifiant la réponse, l'évolution de la couleur de la solution contenant une quantité équimolaire d'ions Cu(II) et de TétraGly (c = 5.10-3 mol·L-1 ) lorsque l'on élève le pH du milieu. 3.1.2 Placer sur une échelle de pH, les zones de prédominance de chacune de ces espèces en faisant apparaître les constantes d'acidité des ions complexes. Les complexes formés présentent des propriétés acides qui peuvent être décrites par les équilibres acido-basiques ci-dessous : h i+ [CuL]+ H [CuLH]2+ [CuL]+ + H+ K0 = [CuLH]2+ = 10-4,03 h i+ [CuLH-1 ] H [CuL]+ [CuLH-1 ] + H+ K1 = [CuL]+ = 10-5,56 h i+ [CuLH-2 ]- H [CuLH-1 ] [CuLH-2 ]- + H+ K2 = [CuLH-1 ] h i+ [CuLH-3 ]2- H [CuLH-2 ]- [CuLH-3 ]2- + H+ K3 = [CuLH-2 ]- = 10-6,91 = 10-9,18 Les constantes d'acidité ont été déterminées à 298 K. En déduire l'allure de la courbe de titration pH en fonction du rapport [nombre de mole de NaOH qui a réagit]/n(Cu(II)) pour le cas d'un mélange équimolaire Cu2+ et LH. 3.2 Interprétation des propriétés électrochimiques du complexe Cu(II)/tétra glycine (G4) Un mélange équimolaire d'ions cuivre(II) et de TétraGly± (c = 100 µ mol · L-1 ) donne les courbes intensité-potentiel représentées sur la figure 2. Les mesures de potentiel montrent la présence de un ou deux paliers de diffusion. Les processus d'oxydation correspondent au couple Cu(II)/Cu(III) sachant que l'oligopeptide, complexé ou non, est supposé non oxydable. La présence d'une ou deux vagues d'oxydation successives traduit l'existence d'un complexe sous une forme plus ou moins protonée [CuLH-3 ]2- ou [CuLH-2 ]- . Le max expérimental mesuré des complexes de Cu(II) formés avec TétraGly à pH 11,6 avant le balayage de potentiel en oxydation est de 515 nm correspondant à la forme [CuLH-3 ]2- . On admettra que l'échange de proton est lent dans le cas de ce système complexe compte tenu de la réorganisation du ligand autour du cation métallique. 11 Figure 2. Voltamogramme en régime de diffusion stationnaire d'un mélange équimolaire Cu(II) / TétraGly± (c = 100 µ mol · L-1 , T = 298 K). 3.2.1 Donner une explication sur la « disparition » de la seconde vague d'oxydation pour le complexe équimolaire Cu(II)/TétraGly, localisée au potentiel de + 0,91 V, lorsque l'on élève le pH du milieu réactionnel. 3.2.2 À l'aide des courbes intensité potentiel présentées sur la figure 2, est-il possible de déterminer une valeur de constante d'acidité ? On admettra que les coefficients de diffusion des formes acide et basique des différents complexes sont du même ordre de grandeur. 12