X Chimie PC 2002
| Thème de l'épreuve | Étude du silicium et ses dérivés. Synthèse stéréosélective de la δ-multistriatine. |
| Principaux outils utilisés | thermochimie, diagrammes d'Ellingham, cristallographie, réactions acido-basiques, chimie organique, RMN |
| Mots clefs | stéréosélectivité, multistriatine, silice, solubilité, rétrosynthèse |
Corrigé
: 👈 gratuite pour tous les corrigés si tu crées un compte👈 l'accès aux indications de tous les corrigés ne coûte que 5 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)






Énoncé obtenu par reconnaissance optique des caractères
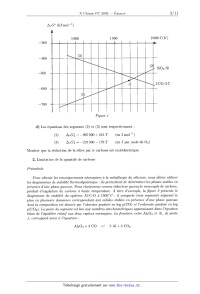
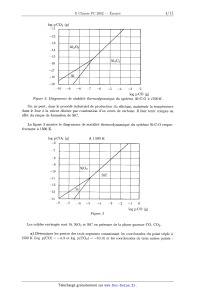
ÉCOLE POLYTECHNIQUE ÉCOLE SUPÉRIEURE DE PHYSIQUE ET DE CHIMIE INDUSTRIELLES CONCOURS D'ADMISSION 2002 FILIÈRE PC COMPOSITION DE CHIMIE (Durée : 4 heures) L'utilisation des calculatrices n'est pas autorisée. L'épreuve comporte deuæ problèmes indépendants. *** Premier problème Silicium, silice et silicates Le silicium est un élément abondant de l'écorce terrestre, avec un pourcentage massique voisin de 29%. Le problème pr0posé aborde les aspects structuraux et thermodynamiques de l'élément silicium, de la silice et de silicates minéraux. Aucune connaissance particulière relative à la chimie de cet élément n'est nécessaire. I - Étude structurale 1. Le silicium Si a) Quelle est la configuration électronique du silicium (Z = 14) dans l'état fondamental? b) Préciser la formule de Lewis et la géométrie spatiale des espèces suivantes : (C6H5)3Si+, SiCl4, SiFg, SiFâ". c) Le silicium cristallise selon un réseau cristallin semblable a celui du carbone diamant. Donner un schéma clair de la maille. (1) Calculer la compacité de cet empilement. Quelles sont les valeurs maximales des rayons des lacunes tétraédriques et octaédriques présentes dans cette maille ? On exprimera ces rayons en fonction du rayon de covalence de l'atome de silicium rS,-, puis on donnera les valeurs numé-- riques approchées des rayons des deux types de lacune. e) Le silicium forme avec le carbone un composé très dur, réfractaire et inerte chimique-- ment, le carbure de silicium SiC. Sachant que le paramètre de maille & passe de 540 pm dans le silicium à 460 pm dans SiC, s'agit--il d'un composé de substitution ou d'insertion '? Quelle est la nature des interactions entre le silicium et le carbone dans ce composé ? Données : 7'5, oe 120 pm; rc % 80 pm; 6. 8 _oe4' \/Ë 2. La silice Sl02 La silice existe, selon la température, sous de nombreuses formes cristallines allotropiques, en particulier le quartz, la tridymite et la cristobalite. On peut facilement décrire le réseau cristallin de la cristobalite, stable à partir de 1470°C, de la manière suivante : il dérive de la structure du cristal de silicium grâce a l'interposition d'un atome d'oxygène entre deux atomes de silicium directement liés. &) Quelle est le nombre d'unités formulaires Si02 par maille ? b) Quelle est la relation entre l'arête de la maille a' et la somme des rayons frs,- + 7°O ? c) Expérimentalement, la distance Si--O--Si n'est pas égale à deux fois la somme précédente; justifier. d) La cristobalite fond a 1723°C. Quelle est la nature des interactions permettant d'expli-- quer cette température de fusion élevée ? II - Étude thermodynamique de la métallurgie du silicium On se propose d'expliquer les conditions choisies industriellement pour la production du silicium. Celle--ci met en oeuvre la réduction de la silice par le carbone, dans un four électrique à arc, a une température de l'ordre de 17 00°C. La difficulté principale tient a ce que l'on doit éviter la formation de carbure SiC, ce qui conduit à traiter dans le four un mélange dosé de sable (Sl02) et de coke (carbone). Données : Tfus(Sl) = 1410°C; Teb(Si) = 2355°C. 1. Utilisation du diagramme d'Ellingham &) Rappeler en quoi consiste l'approximation d'Ellingham. b) Considérant le diagramme d'Ellingham du silicium et du carbone, représenté sur la figure 1, justifier le choix du carbone comme réducteur. Trouver le domaine de température utilisable. c) Expliquer simplement pourquoi les segments (1) et (2) d'une part, (3) d'autre part ont des pentes de signe contraire. Interpréter physiquement le changement de pente au point A. Sachant que l'augmentation de la pente est voisine de 30 J mol"1 K"1, en déduire une estimation de la variation d'enthalpie AtH°(Si) de la transformation mise en jeu. Sous quelle forme physique récupère--t--on le silicium produit par ce procédé ? ATG° (kJ mol--1) 1 000 1 500 2 000 T(K) --300 _400 ll!l!!l=lllll (2D . . S O S _ 500 _l'l'..----!!l!! 1 2/ 1 A 2 CO 2 C _600 ""' A"'.-- / __700 l!!'..l"llll Figure 1 d) Les équations des segments (2) et (3) sont respectivement : (2) A7...G°2 = --907 000 + 213 T (en Jm01--1) (3) ATG'Ê3 : --221 000 -- 179 T (en J par mole de 02) Montrer que la réduction de la silice par le carbone est endothermique. 2. Limitation de la quantité de carbone Préambule Pour obtenir les renseignements nécessaires à la métallurgie du silicium, nous allons utiliser les diagrammes de stabilité thermodynamique : ils permettent de déterminer les phases stables en présence d'une phase gazeuse. Nous choisissons comme réducteur gazeuse le monoæyde de carbone,-- produit d'ooeydation du carbone à haute température. À titre d 'eæemple, la figure 2 présente le diagramme de stabilité du système ALC-O & 1500°C : il comporte trois segments séparant le plan en plusieurs domaines correspondant auæ solides stables en présence d'une phase gazeuse dont la composition est donnée par l 'abscisse graduée en log p(CO) et l 'ordonnée graduée en log p(COg). La pente du segment est liée auæ nombres stoechi0métriques apparaissant dans l'équation - bilan de l'équilibre relatif aust deus: espèces envisagées. La frontière entre A1203 et A1, de pente ], correspond ainsi à l'équation : A1203 + 3 CO Ü-- 2 Al + 3 COQ log P C02 (8) --11 .....flI. --12 r...--lu.-- num.--n..-- nu.--n...-- %--um-m-- OE-nm----- cyan--...-- nam--....-- --10 --9 --8 --7 --6 --5 ----4 --3 --2 log p CO (s) F figure 2. Diagramme de stabilité thermodynamique du système ALC--O & 1500 K. On ne peut, dans le procédé industriel de production du silicium, maintenir la température dans le four à la valeur désirée par combustion d'un excès de carbone. Il faut tenir compte en effet du risque de formation de SiC. La figure 3 montre le diagramme de stabilité thermodynamique du système Si--C--O respec-- tivement à 1500 K. | l III! IIII F igure 3 Les solides envisagés sont Si, Sl02 et SiC en présence de la phase gazeuse CO, 002. &) Déterminer les pentes des trois segments connaissant les coordonnées du point triple à 1500 K (log p(CO) = ----4, 9 et log p(COg) = --10, 8) et les coordonnées de trois autres points : En déduire les équations des équilibres chimiques correspondant aux trois frontières. b) Quelle est la valeur de la variance du système au point triple ? Justifier. c) Donner une valeur approchée de la constante d'équilibre relative à la réduction de la silice en silicium par le monoxyde de carbone à. 1500 K. (1) Déduire des données précédentes les raisons d'une limitation impérative de la quantité de carbone dans le procédé industriel d'élaboration du silicium. III - Régulation de la teneur en silicium dans les eaux naturelles La composition des eaux naturelles est la résultante des interactions entre l'eau et les mi-- néraux (roches). Ainsi, la dissolution, la précipitation et l'altération des phases solides jouent un rôle essentiel pour la concentration des éléments majeurs, tels le calcium ou le silicium, dans les eaux. C'est a l'origine de la présence de ce dernier élément que l'on s'intéresse ci--après, en considérant deux modèles simples. 1. Solubilité de la silice en fonction du pH Le quartz (forme cristalline naturelle de Si02 (s)) et la silice amorphe SiOg (s) ont une solu-- bilité dans l'eau pure caractérisée par les équilibres suivants : Tl SÎOQ(S, quartz) + 2 H20 H4SiO4 log K1 --3, 7 (25°C) SÎOQ(S, amorphe) + 2 H20 ?- H4SiO4 log K2 --2, 7 (25°C) Cependant, cette solubilité varie en fonction du pH par suite des propriétés acides de H4SiO4 : H4SÏO4 + H20 Z--' HgSÏOZ + H30+ log K3 = --9, 5 (25°C) Hgsio4-- + H30+ log K4 = --12, 6 (25°C) Ti Hgsio; + H20 Le diagramme (simplifié) de solubilité totale de SiOg (s, amorphe) en fonction du pH est repré-- senté sur la figure 4. t...; © © SiOg (s) amorphe concentration (M) S &» y._\ °? gx Figure 4 &) Écrire les équations--bilans des équilibres mis en jeu le long des segments de droite du diagramme et justifier la pente de ceux--ci. b) Que peut--on en déduire quant a la solubilité minimale du quartz en solution aqueuse ? Comment peut-on expliquer simplement qu'elle soit inférieure à celle de la silice amorphe ? 2. Dissolution de l'albite sous l'influence du (302 atmosphérique L'albite est un silico--aluminate de sodium qui entre dans la composition des roches (feldspath de sodium). Son altération au contact d'une eau en équilibre avec le (302 atmosphérique conduit a une dissolution partielle accompagnant la transformation de l'albite en un autre silico--aluminate, la kaolinite. Les équilibres acido--basiques à considérer sont les suivants : 1 NaAlSi308 (S) + H3O+ 2 Na+ + 2H4SÎO4 + HQO + -2--A1281205(0H)4(S) log K5 = +1, 9 albite kaolinite soit en abrégé : 1 A(S) + H30+ : Na+ + 2H4SÎO4 + H20 + -2--K(S) et, en notant COg, H20 le dioxyde de carbone dissous (on néglige la forme moléculaire H2C03, très minoritaire (< 0, 3%)) : COg(g) + H20 : COQ, H20 l0g K6 = --1,5 cog, Hgo + H20 : HCOg + H30+ log K7 : --6, 3 HCOg + Hgo : (:O? + Hgo+ log Kg = ----10, 3 &) Sachant que le pH des eaux naturelles est généralement compris entre 7 et 8, quelles sont les formes prédominantes en solution du dioxyde de carbone et de la silice ? b) Écrire l'équation--bilan de la réaction de dissolution partielle de l'albite au contact d'une eau en équilibre avec le 002 atmosphérique, donc impliquant C02 (g), et en déterminer la constante, sous forme de log K. c) Sachant que la pression partielle du C02 atmosphérique est pCO2 = 10--375 atm, quelles sont les concentrations des espèces prédominantes en solution résultant de la mise en équilibre d'albite en excès avec de l'eau pure au contact du C02 atmosphérique ? En déduire le pH de la solution. Comment la solubilité varie--t-elle avec pcgg ? On prendra : log 2 = O, 3 et pg (pression de référence) : 1 atm Deuxième problème Synthèse stéréosélective d'une phéromone : la 5--multistriatine Données RMN Déplacements chimiques (5, ppm) de quelques types d'hydrogènes de molécules organiques variable 1,0 - 5,0 souvent élargi --OH (alcool) -COOR (ester) --CO-(cétone) 3650--3600 (libre) 1750--1730 1710 3500--3250 (lié) I - Structure La 5--multistriatine est la phéromone sexuelle d'une variété de coléoptères parasitant les ormes européens. L'élucidation de sa structure a conduit a la représentation topologique suivante : F z'gure 5 Le spectre RMN 1H de ce composé présente les signaux suivants : Déplacement Multiplicité spectrale Couplage J (Hertz) chimique 5 (ppm)- «» Nombre de protons 1 2- 2,0 massif non résolu (m) @ mullplel 1. Effectuer en justifiant les attributions de ces différents signaux. 2. Préciser la configuration des atomes de carbone asymétriques de la 5--multistriatine. II - Analyse rétrosynthétique La) Quel groupe fonctionnel cette molécule possède--t--elle ? b) Quel composé A obtient--on par hydrolyse de la ô--multistriatine en milieu acide? En détailler le mécanisme sur une représentation simplifiée. 2. Le corps A peut être obtenu par action du tétraoxyde d'osmium (suivie d'hydrolyse en présence d'eau oxygénée) sur un dérivé B. Donner la formule topologique de B. 3. Le composé B peut être converti, par action de l'éthane--1,2--diol en présence d'une trace d'acide fort, en une forme protégée C. Donner la représentation topologique de C. 4. Le dérivé C peut être obtenu par une réaction de Wittig mettant en jeu un composé D et un réactif E préparé à partir de triphénylphosphine et d'iodométhane (ou iodure de méthyle). Quel est ce réactif E ? Dans quelles conditions le prépare--t--on ? Donner la structure du composé antagoniste D. ...,... ......æ--m _ 5. Montrer que le produit D' résultant de l'hydrolyse de D, pourrait théoriquement s'obtenir par addition --1,4-- de l'énolate de la pentan--3--one sur un réactif F approprié. Indiquer la formule du composé F. III - Synthèse stéréosêlective 1. L'analyse rétrosynthétïque effectuée dans la partie précédente pourrait éventuellement servir de base a la synthèse de la ô--multistriatine au départ du réactif F et de la pentan--3-one. Toutefois une telle synthèse ne serait pas efficace. Pourquoi ? 2. On peut, en revanche, envisager la synthèse stéréosélectîve de la ô--multistriatine, sous une forme optiquement active, en partant d'un énantiomère de l'acide tartrique, l'acide (28,38)-- dihydroxybut ane-- 1 ,4--dioïque. Donner la représentation spatiale (selon Gram) d'une conformation anti de la molécule de cet acide tartrique puis en donner une projection de Newman. 3. L'acide (2S,3S)-dihydroxybutane--1,4--dioïque, traité par un excès d'éthanol en présence d'une trace d'acide sulfurique, est converti en un dérivé G dont la stéréochimie a été préservée. Donner le mécanisme de cette réaction et la formule topologique de G. 4. Le composé G traité a froid mole a mole par une solution d'acide bromhydrîque dans l'éthanol est converti en un produit H de formule CgH13BrO5, dont le spectre infra--rouge montre une bande d'absorption vers 1 7 50 cm"1 et vers 3300 cm_1 et dont le spectre RMN est décrit ci--après 6 (ppm) Nombre de protons Multiplicitê spectrale __-- ---ùu ___" &) Donner et justifier la formule développée de H. b) Représenter H selon Newman sachant qu'il possède la configuration R au niveau de ses atomes de carbone asymétriques. c) Proposer un mécanisme réactionnel pour cette transformation. Pour quelle raison opère-- t--on en solution dans l'éthanol et non en solution aqueuse ? 5. Le composé H est traité par de l'éthanolate de sodium en solution dans l'éthanol, ce qui conduit par réaction intramoléculaire a un composé I de formule CgH1205 dont le spectre RMN figure ci--dessous. En infra--rouge on note une absorption a 1 750 cm--1, la disparition de l'absorption à 3300 cm"1 et l'absence d'absorption a 1 710 cm_1. Nombre de protons Multiplicité spectrale a) Donner une représentation spatiale du composé I et interpréter son spectre RMN. b) Indiquer un mécanisme réactionnel pour cette transformation. 6. Le composé I est ajouté sous atmosphère d'argon a une solution dans l'éther anhydre de diméthyl cuprate de lithium maintenue à --50°C. Après réaction et traitement approprié on isole un produit J stéréochimiquement pur de formule C9H1605 dont le spectre IR présente une bande intense a 1 735 cm"1 etune bande d'intensité moyenne vers 3470 cm _°1 ,son spectre de RMN figure ci--après. Nombre de protons --- _ &) Donner la formule développée du produit J en accord avec ces données spectrales. s élargi b) Quel mécanisme réactionnel peut--on proposer pour cette réaction? c) Pouvait--on réaliser cette transformation par action de l'iodure de méthy1magnésium '? (1) Préciser la stéréochimie de J (on attribuera l'indice 3 au carbone non fonctionnalisé) 7. Le composé J est traité en solution dans l'éther anhydre par un large excès d'aluminohy-- drure de lithium. Après traitement approprié on isole un produit K dont le spectre infra--rouge présente une bande intense a 3 320 cm 1. &) Montrer que K ne présente plus qu'un seul type de fonction organique; lequel? b) Pourquoi a--t--on utilisé un large excès de réactif? 8. À une solution de K dans l'acétone (ou propanone) on ajoute une quantité catalytique d'acide paratoluènesulfonique. Après 12 h d'agitation à. température ambiante puis évaporation de l'excès d'acétone, on isole un produit L de formule 08H1603 qui possède la configuration 28,38. 10 &) Donner le mécanisme de cette réaction. b) Montrer qu'elle est susceptible de conduire à différents composés cycliques. c) Sachant qu'il se forme préférentiellement un cycle pentagonal, donner une représentation spatiale du produit L isolé. 9. Le composé L traité par le chlorure de thionyle (SOC12) dans l'éther est transformé en un dérivé M que l'on traite par l'iodure de sodium en solution dans l'acétone. Après élimination d'un précipité par filtration et évaporation du solvant on isole un dérivé N. &) Préciser les transformations effectuées en indiquant les formules de M et de N. b) Quel est le précipité formé au cours de la seconde réaction ? Quel intérêt y a--t-il à. opérer dans l'acétone ? 10. La pentan--3--one est ajoutée à une solution de base forte (diisopropy1amidure de lithium (LDA)) dans le tétrahydrofurane (THF) anhydre à --70°C; après agitation et formation d'un intermédiaire réactionnel, on ajoute le composé N. Après un traitement approprié, on isole le déI'ÏVé () de formule C13H2403. &) Préciser les transformations réalisées au cours de ce protocole en détaillant leur mé-- canisme. Quel est l'intérêt d'avoir transformé M en N avant d'effectuer cette réaction? b) Montrer que 0 est en fait un mélange de deux diastéréoisomères; représenter l'un deux selon Gram en indiquant la configuration de ses atomes de carbone asymétriques. 11. Le mélange 0 en solution dans l'acétonitrile est traité par une solution aqueuse d'acide chlorhydrique a 10% pendant 12 h à température ambiante. Après saturation par du chlorure de sodium, le mélange est extrait a l'éther et la phase organique est lavée avec une solution saturée de NaHCO;>,, séchée sur MgSO4, filtrée et évaporée. Après purification chromatographique on isole le produit P majoritaire qui est la ô--multistriatine cherchée. &) Proposer une suite de mécanismes réactionnels pour la transformation 0 --> P. b) Pour quelle raison sature--t--on par NaCl le mélange réactionnel lors du traitement final? 11