Mines Chimie PC 2013
| Thème de l'épreuve | Étude de quelques composés du ruthénium. Synthèses d'antidépresseurs. |
| Principaux outils utilisés | cristallographie, thermochimie, diagrammes d'Ellingham, mélanges binaires, cinétique chimique, chimie organique |
| Mots clefs | ruthénium, antidépresseurs, sertraline, paroxétine |
Corrigé
: 👈 gratuite pour tous les corrigés si tu crées un compte👈 l'accès aux indications de tous les corrigés ne coûte que 5 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)











Rapport du jury
(télécharger le PDF)





Énoncé obtenu par reconnaissance optique des caractères
A 2013 Chimie PC
ECOLE DES PONTS PARISTECH,
SUPAERO (ISAE), ENSTA PARISTECH,
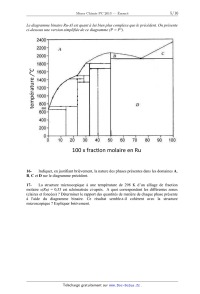
TELECOM PARISTECH, MINES PARISTECH,
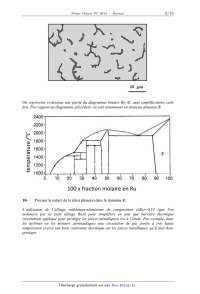
MINES DE SAINT-ETIENNE, MINES DE NANCY,
TELECOM BRETAGNE, ENSAE PARISTECH (FILIERE MP)
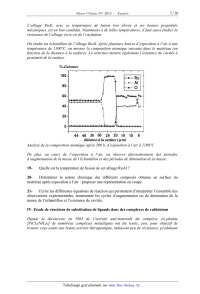
ECOLE POLYTECHNIQUE (FILIÈRE TSI)
CONCOURS D'ADMISSION 2013
EPREUVE DE CHIMIE
Filière : PC
Durée de l'épreuve : 4 heures
Sujet mis à disposition des concours :
Cycle International, ENSTIM, TELECOM INT, TPE-EIVP
Les candidats sont priés de mentionner de façon apparente sur la première page
de la copie
CHIMIE 2013 - Filière PC
L'usage d'ordinateur ou de calculette est interdit.
L 'e'nonce' de cette épreuve, particulière aux candidats de la filière PC,
comporte 1 6 pages.
' Les candidats pourront admettre tout résultat fourni dans l'énoncé, qu'ils
n'auraient pas
établi, mais qui serait utile dans la poursuite de l'épreuve.
' Les candidats ne devront pas hésiter à formuler des commentaires succincts
qui leur
sembleront pertinents, même si l'énoncé ne le demande pas explicitement, à
condition
qu'ils s'inscrivent dans le programme du concours et soient en rapport avec le
problème
posé.
' Le barème tiendra compte de la longueur de l'énoncé.
' Si, au cours de l'épreuve, le candidat repère ce qui lui semble être une
erreur d'énoncé, il
le signale sur sa copie et poursuit sa composition en expliquant les raisons
des initiatives
qu'il est amené à prendre.
Page 1/16 Tournez la page S.V.P.
Chimie 2013 Filière PC
DEBUT DE L'ENONCE
Des données utiles a la résolution du problème sont fournies a la fin de
l'énoncé.
Cette épreuve est constituée de deux parties indépendantes : la première est
consacrée a l'étude
de quelques composés du ruthénium, la seconde a la synthèse d 'antidépresseurs.
Ces parties sont
elles--mêmes divisées en sous--parties largement indépendantes entre elles.
Étude de quelques composés du ruthénium.
Le rutlzénium fut vraisemblablement isolé une première fois en 1808 par un
chimiste
polonais, J. Sniadecki, a partir d'un minerai de platine mais ses travaux ne
furent pas
attestés et il renonça aux droits sur sa découverte.
En 1828, G. Osann pensa avoir décelé la présence de trois nouveaux métaux dont
le
rutlzénium (nom proposé par Osann) dans les résidus insolubles d'un minerai de
platine
dissous dans l'eau régale.
C 'est uniquement en 1844 que le rutlzénium métallique est obtenu pour la
première fois a
l 'état pur par K. Klaus (il parvint a isoler six grammes de métal).
Le rutlzénium tire son nom du latin « Ruthenia », qui signifie « Russie », pays
de naissance
de Klaus.
I. Ruthénium : L'atome et le métal
Le rutlzénium (symbole Ru) a pour numéro atomique Z = 44. Il existe de nombreux
isotopes
naturels du rutlzénium, dont un de masse molaire 101,904 g.moll (31,6 %), et un
autre de
masse molaire 103,905 g.mol" (18, 7 %).
1- Donner la composition des noyaux de ces deux isotopes du ruthénium.
2- La configuration électronique de l'atome de ruthénium dans son état
fondamental est
[Kr]4d75s'z est-ce la configuration attendue selon les règles de remplissage,
que l'on
rappellera ?
3- Localiser le ruthénium dans la classification périodique (période, colonne).
4- Déterminer les numéros atomiques du fer et de l'osmium, éléments situés
respectivement au-dessus et en-dessous du ruthénium dans la classification
périodique.
Exposer clairement le raisonnement.
Page 2/16
Chimie 2013 Filière PC
Le ruthénium est un métal brillant et argenté, d'une grande dureté, qui est
très utilisé en
alliage avec le platine ou le palladium pour augmenter leur dureté et leur
résistance a la
corrosion. La maille élémentaire du réseau est représentée ei-dessous (a = b =
270 pm ;
c =428pm; oc=/3=90°; y= 120°) :
L'atome intérieur a cette maille est situé au centre du triangle équilatéral
dessiné en
pointillés épais.
5- Comment se nomme cette structure du ruthénium métallique ?
6- Déterminer à l'aide des données la valeur prévisible du rayon métallique du
ruthénium.
7- Si l'atome intérieur à la maille est tangent aux atomes situés sur les
sommets les plus
proches, établir la relation entre a et c.
8- Ici le rapport c/a vaut 1,58. Les approximations numériques données en fin
dénoncé
étant précises à 1% près, qu'en conclure ?
II. Corrosion sèche du ruthénium
Dans cette partie, nous allons étudier la thermodynamique de l'oxydation du
ruthénium par
le dioxygène a haute température (et plus particulièrement a 1100°C). En
présence de
dioxygène, le ruthénium peut s 'oxyder en RuOg(s).
9- Ecrire l'équation (notée R1) de la réaction d'oxydation du ruthénium solide
en
Ru02(s) en prenant un coefficient stoechiométrique égal à 1 pour le dioxygène.
Calculer
l'enthalpie standard de réaction et l'entropie standard de réaction à 1100°C.
Expliquer
clairement la méthode et les éventuelles approximations.
Page 3/16 Tournez la page S.V.P.
Chimie 2013 Filière PC
Si l 'on note K1 la constante associée a R1, le calcul conduit a : log(K1) =
3,2.
10- En déduire, à 1100°C, la valeur de la pression de corrosion PC...(OZ(g))
pour le
ruthénium et tracer un diagramme d'existence de Ru(s) et RUOQ(S) en fonction de
10g(P(02(g))/PO)-
11- A l'aide des données, comparer le ruthénium et l'aluminium vis-à-vis de
l'oxydation à
1 100°C.
Les espèces gazeuses qui se forment lors d 'une oxydation a haute température
peuvent avoir
une forte influence sur la vitesse de l'attaque. En présence de dioxygène, le
rutlzénium peut se
sublimer mais aussi s 'oxyder en RuO3(g) et RuO4(g) (en plus de RHOg(S)).
Nous allons tracer le diagramme des espèces gazeuses M(g) a la température de
1100°C :
10g(P(M(g))/PO) =f(10g(P(02(g))/PO))
Pour construire un tel diagramme il faut prendre en compte toutes les réactions
impliquées
dans le processus d'oxydation. Les équations des réactions formant des gaz a
partir de Ru(s)
sont:
log(Kÿ à 1100°C
R2 Ru(s) = Ru(g) log (K2) = - 16,6
R3 Ru(s) + 2 Og(g) = RuO4(g) log (K3) = - 0,6
R4 Ru(s) + 3/2 Og(g) = RuOg(g) log (K4) = - 0,2
12- A l'aide de ces données et du résultat de la question 10-, déterminer
l'expression des
fonctions log(P(M(g))/P°) = f (log(P(Og(g))/PO)) pour les trois gaz Ru(g),
RuOg(g) et RuO4(g)
sur l'intervalle -7 < log(P(Og(g))/PO) < 0. Les gaz seront supposés parfaits. 13- Tracer sur un même graphique l'allure de log(P(M(g))/P°) = f (log(P(Og(g))/PO)) pour les différentes espèces gazeuses du ruthénium. On se limitera à -7 < log(P(Og(g))/PO) < 0, commenter les valeurs respectives des P(M(g)) lorsqu'on est proche de ces bornes. III. Alliages métalliques avec le ruthénium Le rutlzénium peut être utilisé en alliage avec différents métaux. 14- Le ruthénium (Ru) et l'osmium (Os) sont miscibles à l'état solide (avec un très faible écart à l'idéalité) et à l'état liquide. Quelles sont les propriétés physico-chimiques qui doivent être proches pour justifier cette observation ? Est-ce cohérent avec les positions respectives de Ru et Os dans le tableau périodique ? 15- Proposer une allure pour le diagramme binaire isobare solide--liquide Ru-Os. Page 4/16 Chimie 2013 Filière PC Le diagramme binaire Ru-Al est quant a lui bien plus complexe que le précédent. On présente ci-dessous une version simplifiée de ce diagramme (P = P°). 24üü_ --- " "'ff 22üü-- £a anna- 1Eüüfl ° 1Eüü* 14ÜD" 1EÜÜ- 1ÜÜÜ- 3üü- ___ aËË- 4üü-E 2üü- i @ Ü . | | T | "_| l ' Ü "l'E? ËÜ 3Ü 4Û' 5Û EÛ ÎÜ ËÜ 9Ü 1ÜÜ température/ C 100 x fraction molaire en Ru 16- Indiquer, en justifiant brièvement, la nature des phases présentes dans les domaines A, B, C et D sur le diagramme précédent. 17- La structure microscopique à une température de 298 K d'un alliage de fraction molaire x(Ru) = 0,53 est schématisée ci-après. A quoi correspondent les différentes zones (claires et foncées) '? Déterminer le rapport des quantités de matière de chaque phase présente à l'aide du diagramme binaire. Ce résultat semble-t-il cohérent avec la structure microscopique '? Expliquer brièvement. Page 5/16 Tournez la page S.V.P. Chimie 2013 Filière PC )\. \--q7 _,.LJL Ifl' pm On représente ci-dessous une partie du diagramme binaire Ru-Al, sans simplifications cette fois. Par rapport au diagramme précédent, on voit notamment un nouveau domaine E. 24üü - --_-... aaami auaa- 1Eüü* .----------- 13ÜÜH Ë . . 14ÜÜfi . E 12üüf ; = v i 1üüü- . l __ T ., . . 3 |: Ï l l I Ü 1Ü 2G 31] 4D BD BD ?Ü BD Ëü 1ÜÜ température /°C 100 x fraction molaire en Ru 18- Préciser la nature de la (des) phase(s) dans le domaine E. L'utilisation de l 'alliage ruthénium-aluminium de composition x(Ru)=0,53 {que l'on nommera par la suite alliage RuAl pour simplifier) en tant que barrière thermique (revêtement appliqué pour protéger les pièces métalliques) est a l'étude. Par exemple, dans les turbines ou les moteurs aéronautiques une circulation de gaz portés a très haute température exerce une forte contrainte thermique sur les pièces métalliques, qu 'il faut donc protéger. Page 6/16 Chimie 2013 Filière PC L 'alliage RuAl, avec sa température de fusion très élevée et ses bonnes propriétés mécaniques, est un bon candidat. Néanmoins a de telles températures, il faut aussi étudier la résistance de l'alliage vis-d-vis de l'oxydation. On étudie un échantillon de l 'alliage RuAl. Après plusieurs heures d'exposition a l'air a une température de IIOO°C, on mesure la composition atomique suivante dans le matériau (en fonction de la distance a la surface}. La structure montre également l'existence de cavités a proximité de la surface. % d'atomes 1un - "..... - ----- Ru | __ ." Al su- _____ ___ 0 - 'EÛ- }? ...]"... 1.5.1. _ Illlliil+iùiiüü+iiü:' ? :; I'll-III-I-I-IIIII- ' ? 4Ü' "' I-'I.-'I-ll-l l"-' ' 20- @ "huhu:- . 1 l 5 _ Wah... Huntuu+flu -- 45 4D 35 3D 25 2015 1D 5 distance & la surface {y fit} Analyse de la composition atomique après 500 h. d'exposition a l'air a 1 ] 00°C De plus, au cours de l'exposition a l'air, on observe alternativement des périodes d'augmentation de la masse de l'échantillon et des périodes de diminution de la masse. 19- Quelle est la température de fusion de cet alliage RuAl ? 20- Déterminer la nature chimique des différents composés obtenus en surface du matériau après exposition à l'air : proposer une représentation en coupe. 21- Ecrire les différentes équations de réaction qui permettent d'interpréter l'ensemble des observations expérimentales, notamment les cycles d'augmentation ou de diminution de la masse de l'échantillon et l'existence de cavités. IV. Etude de réactions de substitution de ligands dans des complexes de ruthénium Depuis la découverte en 1965 de l'activité anti-tumorale du complexe cis--platine [PtCl2(NH3)2] de nombreux complexes métalliques ont été testés, avec pour objectif de trouver ceux ayant une bonne activité thérapeutique, induisant peu de résistance, produisant Page 7/16 Tournez la page S.V.P. Chimie 2013 Filière PC moins d'effets secondaires et offrant un spectre d'action plus large. Ces complexes doivent être également sufisamment stables et solubles dans le sang. Parmi les complexes testés, les complexes de ruthénium paraissent très prometteurs comme par exemple les deux complexes présentés ci-dessous : Cl" RU\ /\N P .. R L\,'N> Cl , U\NH2
RAPTA-C [Rumô-biloherwl)Cl(en)l+
Dans l'organisme on observe des réactions de substitution de ligands. L 'objet
de cette partie
est d'étudier la cinétique de la réaction de substitution ci-dessous afin d'en
déterminer le
mécanisme. L'évolution de la concentration de 1 est suivie au cours du temps
par RMN du
fluor.
F'©\ Ru CDle =
/ "Cl +P(OMe) ---'--> Ru." + p(Ç}F
P \01 ' (Meo)sP" \C|C' '3
F ©
F
1
Les dfiérents composés sont en solution dans CDCl3. Initialement on introduit
un large excès
de P(OMe)3.
Expérimentalement, la vitesse de la réaction, définie comme étant la vitesse de
disparition du
complexe ] est d'ordre global ] (ordre 1 par rapport au complexe 1). On note
kexp la
constante de vitesse.
22- Donner l'expression de la concentration en complexe 1 en fonction du temps.
Expliquer comment on accède à la valeur de la constante de vitesse kexp à
partir des résultats
expérimentaux.
Page 8/16
Chimie 2013 Filière PC
Deux grands types de mécanisme peuvent être proposés pour cette réaction de
substitution :
Mécanisme dissociatif :
kl
1 <=> C+P(C6H4F)3
k-1
k2
C + P(OMe)3 + 3
Mécanisme associatif :
k3
1 + P(OMe)3<=> D
-3
k4
D à 3 + P(C6H4F)3
23- Proposer une représentation pour les intermédiaires réactionnels C et D.
24- En supposant applicable l'approximation des états quasi-stationnaires,
déterminer
pour chacun des mécanismes une loi de vitesse théorique.
25- Ces deux mécanismes théoriques permettent--ils d'interpréter la loi de
vitesse obtenue
expérimentalement dans les conditions choisies ? A quelle(s) condition(s) ?
Expliquer
soigneusement.
26- L'expérience est effectuée trois fois, toujours avec un large excès de
P(OMe)3 par
rapport au complexe 1, mais en modifiant significativement sa concentration
initiale
[P(OMe)3]O. La constante de vitesse kexp est presque invariante dans les trois
expériences. En
déduire le mécanisme de la réaction.
27- Les résultats précédents permettent--ils d'identifier l'étape cinétiquement
déterminante du mécanisme ? Expliquer.
Dans le cadre de la théorie d 'Eyring, la constante de vitesse kexp d 'un acte
élémentaire varie
avec la température selon la loi :
kBT ex
_ AG"
XP--T "
k _
" RT
Dans cette expression, h est la constante de Planck, kB la constante de
Boltzmann et AG$
l'enthalpie libre d'activation (définie entre l'état de transition et les
réactants).
Page 9/16 Tournez la page S.V.P.
Chimie 2013 Filière PC
La constante de vitesse kexp a été déterminée expérimentalement a différentes
températures.
28- Expliquer comment on détermine à l'aide de ces résultats expérimentaux
l'enthalpie
d'activation AH7É et l'entropie d'activation ASÏ
29- On obtient expérimentalement une entropie d'activation de 37,7 J.K".mol". En
assimilant en première approximation l'entropie standard de l'étape
cinétiquement
déterminante à cette entropie d'activation, ce résultat numérique confirme-t-il
a priori la
nature du mécanisme de substitution ?
Synthèses d'antidépresseurs
La dépression nerveuse est une maladie majeure qui touche entre 5 et 10% de la
population
mondiale. Selon une étude récente, elle coûterait, rien que sur le territoire
des Etats-Unis,
plus de 40 milliards de dollars par an a la collectivité en soins médicaux et
perte de
productivité.
Les antidépresseurs agissent en général sur les taux de neurotransmetteurs
comme la
noradrénaline, la dopamine et la sérotonine, soit en inhibant les enzymes
chargés de leur
dégradation, soit en empêchant leur recapture.
Dans ce problème nous allons étudier les premières synthèses publiées de deux
molécules de
type inhibiteur sélectifi la sertraline (mise sur le marché en 1991} et la
paroxétine (mise sur
le marché en 1992). Ces molécules sont représentées ci-dessous, sans préciser
leur
stéréochimie.
Q
12
sertraline paroxetine
1. Synthèse de la sertraline (W.M. Welch et coll., 1985)
30- Combien existe-t-il de stéréoisomères de configuration de la sertraline ?
Justifier.
31- Parmi tous les stéréoisomères de configuration de la sertraline, le
stéréoisomère cis
dans lequel tous les atomes de carbone asymétriques ont un stéréodescripteur S
est celui
Page 10/16
Chimie 2013 Filière PC
présentant la meilleure activité thérapeutique Le représenter à l'aide des
conventions de
Gram.
La première réaction de la synthèse est présentée ci-après.
0
Cl A|C|3
+
C. ©
Cl
32- Comment se nomme la réaction effectuée ici? Détailler les conditions
expérimentales. Représenter le produit A obtenu.
V
>
33- Proposer un mécanisme pour cette réaction.
Dans le mode opératoire, il est écrit que la réaction est effectuée avec 1,50
mol du chlorure
d 'acyle, un excès de benzène et 1,64 mol de trichlorure d'aluminium AlCl3.
34- Justifier les quantités relatives employées.
35- En fin de réaction, après une heure d'agitation, le mélange réactionnel est
versé sur un
mélange d'eau et de glace, puis agité. Quel est l'intérêt d'une telle opération
?
On effectue ensuite une réaction dite « de Stobbe » (H. Stobbe, 1893).
La réaction est effectuée dans le tertiobutanol (t--BuOH), en présence de
tertiobutanolate de
potassium (t--BuOK). Dans ce milieu, la réaction du composé A avec le
butanedioate de
diéthyle conduit au composé B représenté ci-clessous (notations : Et, groupe
éthyle --CH2CH3
et t--Bu, groupe tertiobutyle --C ( CH 3) 3).
C02H
C02 Et
EÏO |
0 1) tBuO@K®dans tBuOH
A + = 0 0 B
0 2) H20 puis HCI 10 % @
OEt Cl
L'obtention du monoester B en fin de réaction peut paraître surprenante et nous
allons
essayer de déterminer le mécanisme de cette réaction.
Page 11/16 Tournez la page S.V.P.
Chimie 2013 Filière PC
Au cours de la première phase de la réaction (avant l 'addition d 'eau), on
détecte la présence
dans le milieu réactionnel de la lactone intermédiaire A ' représentée ci-après.
0
CO Et
0 2
O O A'
Cl
Cl
36- Proposer un mécanisme qui explique la formation de la lactone A' à partir
de A.
37- Proposer un mécanisme menant au composé B en partant de la lactone A'.
Après un reflux pendant 3 6h du composé B en milieu acide (mélange d 'acides
éthanoique et
bromhydrique), on isole le composé C représenté ci-dessous.
COZH
|
O O °
Cl
Cl
38- Au cours de la réaction de formation de C, un gaz se dégage. L'identifier.
Donner la
structure du composé (neutre) qui se forme intermédiairement dans le milieu. En
mettant à
profit la présence d'une double liaison éthylénique dans cet intermédiaire,
proposer un
mécanisme simple expliquant le dégagement gazeux.
Le composé C est dissous dans de l'acétate d 'éthyle. On ajoute dans cette
solution du
palladium sur charbon, et on y fait barboter du dihydrogène. Après traitements
on isole le
composé D.
39- Représenter le composé D.
40- La réaction de formation de D est-elle stéréosélective ? Justifier.
Par action sur D d 'un léger excès de chlorure de thionyle SOCl2 on obtient un
composé E.
41- Donner la structure de Lewis de SOCl2. Ecrire l'équation de la réaction et
donner la
structure de E. Observe-t-on un dégagement gazeux dans cette étape ? Si oui,
lequel ?
Page 12/16
Chimie 2013 Filière PC
Le composé E obtenu est dissous dans du disulfure de carbone CS 2 puis on
ajoute un large
excès de trichlorure d'aluminium AlCl3. Après 16 heures d'agitation a
température ambiante
et addition d'eau enfin de réaction, on obtient un composé F.
42- Justifier le fait d'avoir choisi CSg. Montrer que l'intermédiaire formé au
cours de cette
réaction, très réactif, peut potentiellement réagir sur différents sites et
conduire ainsi à
différents produits. Représenter le produit F obtenu (très majoritairement) et
justifier
soigneusement la sélectivité.
43- Suggérer une préparation de la sertraline en partant de F et de méthylamine
CH3NH2.
Indiquer schématiquement la suite de réactions envisagées, les éventuels
réactifs
supplémentaires et les conditions opératoires.
II. Synthèse de la paroxétine (J .A. Christensen et R.F. Squires, 1977)
La synthèse étudiée ici va nous conduire a l'obtention d'un seul stéréoisomère
de
configuration de la paroxétine (voir la structure de la paroxétine en début de
problème).
La première étape de la synthèse est une réaction entre le bromure de p-
fiuorophénylmagnésium et le composé G représentés ci-dessous. Cette réaction
est suivie
d 'une hydrolyse acide qui conduit au composé H.
0 F
\ OCH3
+ > H
'Î' G
MgBr
44- Montrer que la molécule G possède deux sites susceptibles d'être attaqués
par
l'organomagnésien.
45- L'étude du composé H par spectroscopie infrarouge indique que la fonction
ester a été
préservée au cours de la réaction. En déduire la structure du composé H.
Proposer un
mécanisme pour la formation de H.
46- Combien existe-t-il de stéréoisomères de configuration du composé H ?
Justifier.
A la fin de cette première réaction on obtient un mélange de tous les
stéréoisomères de
configuration du composé H. Si l'on dissout ce mélange dans du benzène en
présence de
méthanolate de sodium CH 3ONa et que l 'on chauffe au reflux pendant 2 heures,
on récupère
a la fin uniquement le mélange racémique trans pur du composé H.
47- Quelles sont les précautions expérimentales à prendre pour réaliser cette
étape ?
Donner les pictogrammes de sécurité pour le benzéne et le méthanolate de sodium.
Page 13/16 Tournez la page S.V.P.
Chimie 2013 Filière PC
48- Donner une représentation de Gram des stéréoisomères du mélange racémique
trans
pur du composé H.
49- Proposer un mécanisme pour cette réaction d'isomérisation.
50- Qu'en déduire sur les stéréoisomères trans de H par rapport aux
stéréoisomères cis ?
51- Quel équilibre conformationnel peut-on écrire pour chacun des
stéréoisomères trans
de H ? Une des deux conformations est-elle plus stable ? Justifier. On indique
que le cycle
azoté adopte une conformation de type cyclohexanique chaise.
Une solution aqueuse d 'acide chlorhydrique contenant le mélange H est portée
au reflux,
puis distillée. Après évaporation des solvants, le solide résultant est soumis
a l 'action d'un
léger excès de chlorure de thionyle SOCl2. On obtient alors le composé I
(mélange
racémique).
52- Quel est le rôle de la distillation lors du chauffage de H en milieu
chlorhydrique
aqueux ? Représenter un des stéréoisomères I obtenus.
Sur le mélange I en solution dans la pyridine a 00EUR, on ajoute un équivalent
de (-)-menthol
Après traitements (extraction, séchage et évaporation du solvant) on obtient un
liquide (L).
Les constituants de ce liquide sont séparés. On poursuit la synthèse avec un
des constituants
que l'on a isolé, noté ], qui sera précisé ultérieurement.
th | @ Id.
\\ ' 'lllen 0 p rl me
N
53- Que signifie le (-) dans le nom (-)--menthol ?
54- Représenter les constituants du liquide.
55- Proposer un mécanisme pour la réaction effectuée. On précisera le rôle joué
par la
pyridine.
56- Proposer une technique pour séparer les constituants du mélange, la décrire
en
quelques lignes.
57- Expliquer le rôle du (-)-menthol dans cette synthèse.
Page 14/16
Chimie 2013 Filière PC
58- Proposer une méthode (plusieurs réactions peuvent être nécessaires) pour
obtenir le
composé K ci-dessous à partir de J qu'on précisera, sans modification de la
configuration de
ses atomes de carbone asymétriques. Les mécanismes des réactions ne sont pas
demandés.
Dans du méthanol on ajoute un morceau de sodium (0,2 mol). A la fin du
dégagement gazeux
on ajoute 0,2 mol de sésamol (composé L ci-apre's} puis 0,2 mol du composé K.
En fin de
réaction on isole le composé M
OH
L
O
O\/
59- Ecrire les équations des différentes réactions qui se produisent (indiquer
la nature du
dégagement gazeux). Préciser la structure du composé M.
60- Préciser la nature du mécanisme lors de la réaction avec le composé K.
Justifier.
Les deux dernières étapes de la synthèse, non étudiées ici, permettent
d'obtenir N, un des
stéréoisomères purs correspondant a la structure de la paroxétine donnée sans
stéréochimie
au début du problème, et ceci sans modifier la configuration des atomes de
carbone
asymétriques présents depuis K. Des tests ont montré que seul le stéréoisomère
(-)-trans-
(38,4R) est actif {dans le cycle azoté l'atome d'azote porte le numéro 1),
c'est donc ce
stéréoisomère qui est la paroxétine.
61- Représenter le stéréoisomère de configuration N finalement obtenu. Est-ce la
paroxétine ?
Page 15/16 Tournez la page S.V.P.
Chimie 2013 Filière PC
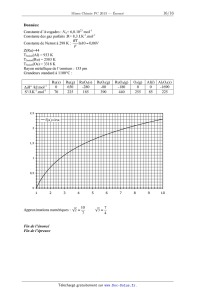
Données:
Constante d'Avogadro : NA= 6,0.1023 mol"1
Constante des gaz parfaits :R= 8,3 J.K'1.Inol'1
Constante de Nernst à 298 K : %1n10 = 0,06V
Z(Ru)=44
Tfusion(A1) = 933 K
Tfusion(Ru) : 2583 K
Tfusion(OS) = 3318 K
Rayon métallique de l'osmium : 135 pm
Grandeurs standard à 1100°C :
Ru(s) Ru(g) RuOg(s) RuOg(g) RuO4(g) 02(g) Al(l) A1203(S)
AfH° /kJ.mol'1 0 650 -280 -80 -180 0 0 -1690
S°/J.K'l.mol'l 70 225 185 390 440 255 85 225
--f(x)=lnx
Approximations numériques : \Î ... % @ z 1
Fin de l'énoncé
Fin de l'épreuve
Page 16/16