Mines Chimie PC 2012
| Thème de l'épreuve | Quelques propriétés du bore et de ses dérivés. Synthèse et utilisation du resvératrol. |
| Principaux outils utilisés | atomistique, diagramme d'Ellingham, diagramme potentiel-pH, cinétique, solutions aqueuses, chimie organique |
| Mots clefs | bore, resvératrol |
Corrigé
: 👈 gratuite pour tous les corrigés si tu crées un compte👈 l'accès aux indications de tous les corrigés ne coûte que 5 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)













Rapport du jury
(télécharger le PDF)





Énoncé obtenu par reconnaissance optique des caractères
A 2012 Chimie PC
ÉCOLE DES PONTS PARISTECH,
SUPAERO (ISAE), ENSTA PARISTECH,
TELECOM PARISTECH, MINES PARISTECH,
MINES DE SAINT-ETIENNE, MINES DE NANCY,
TELECOM BRETAGNE, ENSAE PARISTECH (FILIERE MP)
ÉCOLE POLYTECHNIQUE (FILIÈRE TSI)
CONCOURS D'ADMISSION 2012
EPREUVE DE CHIMIE
Filière : PC
Durée de l'épreuve : 4 heures
Sujet mis à disposition des concours :
Cycle International, ENSTIM, TELECOM INT, TPE-EIVP
Les candidats sont priés de mentionner de façon apparente sur la première page
de la copie
CHIMIE 2012 - Filière PC
L'usage d'ordinateur ou de calculette est interdit.
L'énoncé de cette épreuve, particulière aux candidats de la filière PC,
comporte 21 pages.
·
·
·
·
Les candidats pourront admettre tout résultat fourni dans l'énoncé, qu'ils
n'auraient pas
établi, mais qui serait utile dans la poursuite de l'épreuve.
Les candidats ne devront pas hésiter à formuler des commentaires succincts qui
leur
sembleront pertinents, même si l'énoncé ne le demande pas explicitement, à
condition
qu'ils s'inscrivent dans le programme du concours et soient en rapport avec le
problème
posé.
Le barème tiendra compte de la longueur de l'énoncé.
Si, au cours de l'épreuve, le candidat repère ce qui lui semble être une erreur
d'énoncé, il
le signale sur sa copie et poursuit sa composition en expliquant les raisons
des initiatives
qu'il est amené à prendre.
Page 1/21
Tournez la page S.V.P.
Chimie 2012 Filière PC
DEBUT DE L'ENONCE
Des données utiles à la résolution du problème sont fournies à la fin de
l'énoncé.
Les gaz sont assimilés à des gaz parfaits et les phases solides sont non
miscibles.
La notation E°' des diagrammes potentiel-pH représente le potentiel standard
apparent (somme
des termes potentiel standard et de dépendance au pH dans l'expression du
potentiel des couples
considérés).
Ce problème traite de différents aspects de la chimie du bore et de ses
dérivés. La première
partie concerne l'élément bore et ses voisins dans la classification
périodique. Les deuxième,
troisième et quatrième parties s'intéressent à la structure cristalline et à
l'élaboration des
nitrures de bore. Les trois parties suivantes étudient les propriétés chimiques
de trois dérivés de
l'élément bore : l'acide borique, le borohydrure de sodium et le borax. Enfin,
les trois dernières
parties proposent deux applications du bore en chimie organique au travers de
la synthèse du
resvératrol et de ses dérivés.
Ces différentes parties sont assez largement indépendantes les unes des autres.
I - Quelques propriétés du bore et de ses dérivés.
Le bore, découvert en 1808 par Sir H. Davy, est un métalloïde noir, brillant et
dur. Il se
combine avec de nombreux éléments pour former des borures avec les métaux (moins
électronégatifs que B), des nitrures avec l'atome d'azote (plus électronégatif
que B), des
borates ou des perborates avec l'oxygène et du borane ou des borohydrures avec
l'hydrogène.
A- Le bore et ses voisins.
1-
Après avoir énoncé les règles permettant de l'établir, donner la configuration
électronique de l'atome de bore dans son état fondamental. En déduire les
degrés d'oxydation
stables du bore.
Page 2/21
Chimie 2012 Filière PC
Dans le tableau suivant sont données quelques propriétés caractéristiques des
éléments de la
colonne du bore :
2-
Elément
Rayon atomique
Energie de première
Electronégativité de
B
(pm)
85
ionisation (kJ.mol-1)
801
Pauling
2,0
Al
125
578
1,6
Ga
130
579
1,8
In
155
558
1,8
Tl
190
589
1,6
Rappeler la définition de l'énergie de première ionisation et celle de
l'affinité
électronique. Comment évolue globalement l'énergie d'ionisation le long d'une
ligne ou d'une
colonne du tableau périodique ? (aucune justification n'est demandée)
3-
Le bore se démarque des autres éléments de sa colonne, qui sont tous des métaux.
Pour cette raison et compte tenu de sa place dans le tableau périodique, il est
parfois qualifié
de « métalloïde ». Justifier qualitativement ce terme en utilisant les données
du tableau
précédent.
B- Structure du nitrure de bore.
Le nitrure de bore est un composé binaire de bore et d'azote de formule BN. Il
existe
principalement sous deux formes cristallines : une hexagonale (h-BN) similaire
à celle du
graphite et l'autre cubique (c-BN) similaire à celle du diamant où les atomes
de C sont
remplacés par les atomes de B et N de telle sorte que les plus proches voisins
des atomes de
B sont des atomes de N et réciproquement. La forme c-BN du nitrure de bore est
alors un
des matériaux les plus durs et a des applications comme revêtement de surfaces
et comme
agent abrasif.
4-
Dans la structure critalline c-BN, les atomes B et N portent-ils des charges
formelles ?
Expliquer succinctement le raisonnement.
Page 3/21
Tournez la page S.V.P.
Chimie 2012 Filière PC
5-
Sachant que le paramètre de la maille cubique vaut 0,362 nm, calculer la
longueur de
la liaison B-N.
6-
L'hétérocycle, analogue du benzène, contenant dans son cycle trois atomes de
bore et
d'azote s'appelle la borazine. Dessiner la forme de Lewis la plus stable.
Pourquoi le cycle estil symétrique ? La distance entre un atome de bore et un
atome d'azote vaut 0,145 nm.
Comparer cette distance avec celle calculée en question 5- , commenter.
C- Elaboration du nitrure de bore.
Le nitrure de bore hexagonal (h-BN) peut être obtenu par différentes méthodes
utilisant
comme dérivés azotés l'ammoniac ou le diazote, on s'intéressera plus
particulièrement à ce
dernier cas.
7-
Equilibrer les réactions de formation des deux nitrures BN et Fe4N à partir des
corps
purs et du diazote (on imposera un coefficient stoechiométrique de 1 pour N2).
8-
A l'aide des données thermodynamiques (cf fin de l'énoncé) et par analogie avec
les
diagrammes d'Ellingham classiques, représenter (sans faire de calculs précis,
mais en
justifiant) l'allure des diagrammes d'Ellingham entre 0 et 3000 K pour les deux
nitrures en
utilisant le diazote comme gaz de réaction.
" pN %
On appelle Y = RT ln$ 2 '
# p° &
9-
Exprimer !rG en fonction de !rG° et Y. En déduire les zones d'existence des
différentes espèces.
10-
Peut-on obtenir le nitrure de bore par réaction entre le nitrure de fer et le
bore
métallique ? Justifier.
Page 4/21
Chimie 2012 Filière PC
D- L'acide borique.
L'acide borique de formule .' H3BO3 est un composé chimique utilisé comme
antiseptique et
insecticide, et comme absorbeur de neutrons dans les centrales nucléaires.
Ce composé est un acide faible (AH), les tables lui attribuent un pKa de 9,2.
Pour des
concentrations supérieures à 0,1 mol.L" environ, les solutions d'acide borique
sont plus
acides qu 'attendu (voir figure 1 ). En eflet, il se forme alors un oligomère
cyclique (Aan) qui
induit une modification de l'équilibre acide--base imposant le pH. L'étude de
la variation de
pH en fonction de la concentration c d'acide borique permet de déterminer la
formule et la
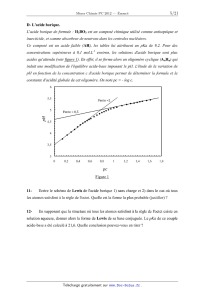
constante d'acidité globale de cet oligomère. On note pc = -- log c.
() 0.2 (),4 0,6 0,8 l 1,2 1,4 1,6 1,8
pc
Figure 1
11- Ecrire le schéma de Lewis de l'acide borique 1) sans charge et 2) dans le
cas où tous
les atomes satisfont à la règle de l'octet. Quelle est la forme la plus
probable (justifier) ?
12- En supposant que la structure où tous les atomes satisfont à la règle de
l'octet existe en
solution aqueuse, donner alors la forme de Lewis de sa base conjuguée. Le pKa
de ce couple
acide-base a été calculé à 21,6. Quelle conclusion pouvez-vous en tirer ?
Page 5/21 Tournez la page S.V.P.
Chimie 2012 Filière PC
13-
Sachant qu'en solution la base conjuguée de l'acide borique est l'ion borate
B(OH)"4 ,
proposer une structure raisonnable de l'acide borique en solution aqueuse.
14-
Justifier la valeur de la pente observée dans la figure 1 pour les
concentrations
inférieures à 0,1 mol.L-1.
On suppose que pour les fortes concentrations, il ne se forme qu'un seul
oligomère (AnHn)
contenant n entités d'acide borique. On a alors les réactions prépondérantes:
On fera l'hypothèse que la forme AH reste très majoritaire par rapport à AnHn,
mais qu'elle
est en revanche nettement moins dissociée et que c'est donc en fin de compte
AnHn qui
impose le pH.
15-
Déterminer la nouvelle relation reliant pc au pH. Quelle est alors la valeur de
n que
l'on peut déduire de la figure 1 ?
16-
A partir de la valeur de n déterminée précédemment, proposer une structure de
Lewis
de l'oligomère cyclique de l'acide borique.
17-
Préciser la structure possible de la base conjuguée. Montrer que cette base
conjuguée
se ponte pour former l'anion tétraborate H4B4O72- , représenté ci-dessous,
contenu dans le
borax.
Page 6/21
Chimie 2012 Filière PC
E- Le borohydrure de sodium, un réducteur doux.
Le borohydrure de sodium NaBH4 a été découvert par Schlessinger en 1940. Il est
synthétisé
par réaction entre le triméthylborate (B(OCH3)3) et l'hydrure de sodium (NaH)
vers 260°C.
Depuis sa découverte, le borohydrure de sodium est utilisé dans un grand nombre
de
réactions chimiques en tant qu'agent réducteur. Sa réactivité plus faible que
l'aluminohydrure de lithium LiAlH4 le rend plus commode d'emploi.
18-
Donner une structure de Lewis de l'ion borohydrure, préciser sa géométrie selon
la
méthode V.S.E.P.R. et la polarité des liaisons. Expliquer succinctement la
différence de
réactivité entre les ions borohydrure et aluminohydrure.
Le borohydrure de sodium est soluble dans l'eau (et les alcools). Mais sa
stabilité dépend des
conditions de pH.
19-
Equilibrer l'équation bilan de la réaction redox de décomposition du
borohydrure de
sodium dans l'eau en milieu basique. Montrer par un raisonnement simple que le
borohydrure
de sodium est thermodynamiquement instable dans l'eau sur toute la gamme de pH
variant de
0 à 14.
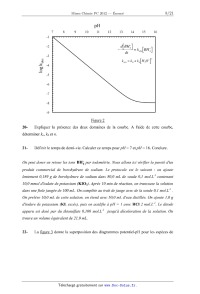
La cinétique d'hydrolyse du borohydrure suit une loi du premier ordre avec une
constante
+
cinétique kobs (en s-1) qui dépend de la concentration en ions H3O . On donne
l'évolution de
log(kobs) en fonction du pH (figure 2).
Page 7/21
Tournez la page S.V.P.
Chimie 2012 Filière PC
pH
7 8 9 10 11 12 13 14 15 16
log 1<{(lbs | til -(3 Figure 2 20- Expliquer la présence des deux domaines de la courbe. A l'aide de cette courbe, déterminer k... kh et n. 21- Définir le temps de demi-vie. Calculer ce temps pour pH = 7 et pH = 16. Conclure. On peut doser en retour les ions BH:l par iodométrie. Nous allons ici vérifier la pureté d'un produit commercial de borohydrure de sodium. Le protocole est le suivant .' on ajoute lentement 0,189 g de borohydrure de sodium dans 80,0 mL de soude 0,1 mol.L'l contenant 10,0 mmol d 'iodate de potassium (KIO3). Après 10 min de réaction, on transvase la solution dans uneflolejaugée de 100 mL. On complète au trait dejauge avec de la soude 0,1 mol.L'l . On prelève 10,0 mL de cette solution, on étend avec 50,0 mL d'eau distillée. On ajoute 1,0 g d 'iodure de potassium (KI, excès), puis on acidifle à pH = 1 avec HC] 2 mol.L'l. Le diiode apparu est dosé par du thiosulfate 0,100 mol.L'l jusqu'à décoloration de la solution. On trouve un volume équivalent de 21,0 mL. 22- La figure 3 donne la superposition des diagrammes potentiel-pH pour les espèces de Page 8/21 Chimie 2012 Filière PC l'iode d'une part et celles du bore d'autre part. La reproduire sommairement et indiquer dans chaque domaine les espèces prédominantes. LS g" 0 \--J a m -()_5 -1 -1.5 0 l 2 3 4 5 6 7 8 9 10 11 12 13 14 pH Figure 3 23- Equilibrer les équations bilan des trois réactions redox intervenant dans le protocole. Expliquer l'ajout d'ions iodure et le passage en milieu acide pour obtenir le diiode. 24- Calculer le nombre de moles de borohydrure dans la prise d'essai. Quelle est la pureté du borohydrure commercial ? Le borohydrure de sodium NaBH4 est un réducteur doux très utilisé en chimie organique. 25- Quelles sont les fonctions réduites par le borohydrure de sodium ? Le borohydrure de sodium NaBH4 associé au diiode réduit les acides carboxyliques en alcools. Pour ce faire, on ajoute 2 équivalents de NaBH4 à une solution d 'acide carboxylique dans le tetrahydrofurane THF. On observe un dégagement gazeux. Ensuite ] équivalent de diiode dans le THF est introduit goutte à goutte, la coloration du diiode disparaît à chaque Page 9/21 Tournez la page S.V.P. Chimie 2012 Filière PC goutte ajoutée. La solution est ensuite chaujfée, refroidie, puis hydrolysée en milieu acide. L'extraction du mélange réactionnel conduit a l 'obtention de l 'alcool. 5 "Q" _... _ _ - ,H NaBHA 0 H |; H .0 0 /U\ {H _. gaz + /|J\ B'H _-- --> )-- --*H20 J--
R 0 , \ ' H H
H ".0 H " lH " H
26- Quel est le gaz qui se dégage au cours de la réaction?
27- Le diiode est considéré comme un bon électrophile, pourquoi ? Sachant qu'il
réagit
avec le composé E et que HI est alors formé, donner la formule du composé Q
(composé
neutre).
28- Quelle est la conséquence sur l'électrophilie du carbone du carboxyle du
composé Q ?
Montrer que ce dernier peut alors subir l'attaque nucléophile d'un ion H _.
29- Quelle doit être la stoechiométrie minimum entre le borohydrure et l'acide
carboxylique ?
F- Le borax, complexation des dérivés hydroxylés du bore.
Le borax, minerai de bore naturel, est appelé aussi tétraborate de sodium. La
formule
générique de ce minerai est .' NaZB4O7, 10H20. En milieu aqueux, il s'hydrolyse
pour donner
une solution tampon contenant le couple acide--base H3BO3/ B(OH)4-.
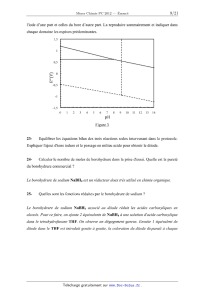
30- Donner la réaction d'hydrolyse du borax. Pourquoi la solution obtenue
est-elle
"tampon" ? Quel est son pH ?
Les dérivés hydroxylés du bore tétravalent forment des complexes avec certains
composés
possédant des groupements hydroxyle. Pour que cette complexation ait lieu, il
est impératif
que les groupements -OH soient adjacents et en position cis. La molécule la
plus simple
Page 10/21
Chimie 2012 Filière PC
ayant cette configuration est l 'éthane--l,2--diol Mais, comme la constante de
complexation est
faible, on préfère utiliser ici le mannitol (M), dont la structure est donnée
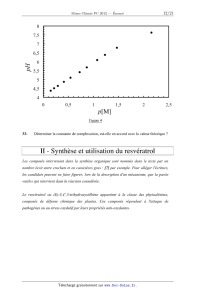
ci--après.
' DH
En présence d'un excès de mannitol, on peut supposer que seul le complexe 1/2
se forme.
_ HO OH R
B(0H)4 +2 >--< --: ]:Z£è ÎZÏï +4H20 Kf =10"511 R R' RI complexe 1/2 31- Calculer la constante de complexation entre le mannitol et l'acide borique conduisant au même complexe que ci-dessus. Montrer alors que si les concentrations en mannitol ne sont pas trop grandes, on peut estimer que seule l'espèce basique est complexée. 32- En supposant cette dernière condition remplie et que le couple acide+mannitol reste un acide faible, donner la relation permettant de calculer le pH de la solution préparée à la question 30- en fonction de la concentration en mannitol. Afin de déterminer la constante de complexation, on utilise le protocole suivant: Dans un bécher de 100 mL, on introduit 5 mL d'une solution de borax 0,050 mol/L et on ajoute 50 mL d'eau distillée a la pipette jaugée. On ajoute du mannitol solide (M, masse molaire M=182,17 g/mol, solubilité s =l8,2 g/100 mL) par portions de 0,25 gjusqu'â ] g, puis par portions de I g jusqu 'a 7 g. On laisse agiter 2 min après chaque ajout, avant de relever la valeur du pH une fois celui--ci stabilisé. Les résultats expérimentaux sont présentés sur la figure 4 grâce a la courbe pH = f(p[M] ) ou [M] est la concentration en mannitol restant dans le bécher après complexation avec les ions borate initialement présents. On note p[M] = -- log [M]. Page 11/21 Tournez la page S.V.P. Chimie 2012 Filière PC 7,5 635 535 4,5 0 0,5 1 1,5 2 25 MW Figure 4 33- Déterminer la constante de complexation, est-elle en accord avec la valeur théorique ? II -- Synthèse et utilisation du resvératrol Les composés intervenant dans la synthèse organique sont nommés dans le texte par un nombre écrit entre crochets et en caractères gras .' [7] par exemple. Pour alléger l écriture, les candidats peuvent ne faire figurer, lors de la description d'un mécanisme, que la partie «utile» qui intervient dans la réaction considérée. Le resvératrol ou (E)--3,4',5--trihydroxystilbe'ne appartient a la classe des phytoaléxines, composés de défense chimique des plantes. Ces composés répondent à l'attaque de pathogènes ou au stress oxydatif par leurs propriétés anti--oxydantes. Page 12/21 Chimie 2012 Filière PC ...) resveratrol O 0 OH HO Certaines études attribuent au resvératrol une activité dans la prévention du cancer, de l'inflammation et de l'agrégation plaquettaire. Naturellement présent dans le vin rouge, il pourrait être une des raisons du «french paradox » .' terme qui désigne l'apparente contradiction entre le régime alimentaire riche en graisses et le faible taux de mortalité par infarctus de la population française G- Synthèse du resvératrol Compte tenu des faibles quantités présentes dans les composés naturels, il est dijficile de l 'obtenir en fortes quantités par les méthodes d 'extraction classiques. On propose donc d'étudier une séquence réactionnelle simple. Synthèse du précurseur [4] (CsHst). 34- La réduction du nitrobenzène par de l'étain (Sn) en milieu acide conduit après basification du milieu à [1]. Donner la structure de [1]. 35- Comment obtenir la N--méthylaniline [2] à partir de [l] ? Quel est l'inconvénient de cette méthode ? Une seconde méthode est proposée ci--dessous .' H ! N 0Et N N BH * ... "H°'°E"3 Y -----a " Ü "" H ' H puis hydrolyse [2] 36- Montrer que l'orthoformiate d'éthyle HC(OEt)3 est un réactif électrophile qui peut Page 13/21 Tournez la page S.V.P. Chimie 2012 Filière PC être activé par protonation. Détailler le mécanisme de la première étape. 37- Combien d'équivalents d'ions hydrure sont nécessaires à la seconde étape ? En utilisant l'écriture simplifiée H _, proposer un mécanisme probable de cette étape. On réalise ensuite la synthèse de [3] (N--méthylformanilide) selon la réaction .' | N... CHS "\ + HCOOH --b-- CH3 [2] [3 ] 38- De quel type de réaction s'agit-il? Pourquoi ne se fait-elle pas facilement? En proposer une variante pour passer de [2] à [3] et donner les conditions expérimentales. Le l--bromo--4--métboxyben2ène est transformé en composé de Grignard. On détaille ci-- dessous le mode opératoire et le dosage de l 'organomagnésien. Dans un ballon tricol rodé a fond plat de 150 mL muni d'un réfrigérant (surmonté d'une garde a chlorure de calcium}, d'une ampoule à brome et d'un barreau aimanté, on introduit 0,25 g de magnésium (masse molaire M=24,30 g/mol) en copeaux fraîchement écrasés. Le troisième col est fermé par un bouchon (le matériel doit être sec, donc conservé à l 'étuve). Dans un erlenmeyer rodé de 100 mL, on pèse 10 mmol de l--bromo--4--méthoxyben2ène (masse molaire M=187 g/mol). A l'aide d'une pipettejaugée, on ajoute 20 mL de THF anhydre et l'on homogénéise (on suppose en première approximation que le volume total reste constant). On verse la solution limpide dans l'ampoule a brome. On bouche l'ampoule d'addition et l'on introduit 5 mL de la solution dans le tricol de manière à recouvrir le magnésium. On ajoute un cristal de diiode. On chaufle vers 50°C. Lorsque la réaction a démarré (ébullition, disparition de 12), on ajoute goutte à goutte le reste de la solution. Une fois l'addition terminée, on maintient l 'ébullition pendant 20 min. 39- Ecrire l'équation bilan de la réaction globale de synthèse. Quel est le rôle du diiode dans cette réaction ? Page 14/21 Chimie 2012 Filière PC Le mélange réactionnel est refroidi et l'organomagnésien est dosé par iodométrie. En présence d'un excès de diiode (solution toluénique), le magnésien réagit mole à mole avec I2 et le diiode qui n'a pas réagi est dosé en retour par le thiosulfate de sodium (Na2S2O3) à 0,100 mol.L-1. Dans deux erlenmeyers de 50 mL rodés, on introduit 10,0 mL de la solution de diiode dans le toluène. Dans le second erlenmeyer, on ajoute goutte à goutte 1,0 mL de magnésien prélevé avec une pipette jaugée sèche et on agite. Sous agitation vigoureuse (milieu biphasique), on dose I2 par le thiosulfate de sodium présent dans l'erlenmeyer témoin et on trouve un volume équivalent v1 = 20,0 mL à la décoloration totale des deux phases, tandis que dans le second erlenmeyer on trouve un volume équivalent v2 = 12,0 mL. 40- Ecrire les réactions redox qui ont lieu au cours de ce dosage. Calculer le nombre de moles de magnésien synthétisé. Quel était le réactif en défaut dans cette synthèse ? En déduire le rendement de la synthèse magnésienne. 41- Le diiode est-il plus soluble dans le toluène ou dans l'eau ? Pourquoi finit-il par passer en phase aqueuse où il peut être dosé ? Le composé de Grignard précédent est opposé à une quantité stoechiométrique de [3]. 42- Quel est le composé obtenu dans le THF (avant hydrolyse) ? Le mélange réactionnel est ensuite hydrolysé avec une solution saturée en chlorure d'ammonium. Après trois extractions au dichlorométhane de la phase aqueuse puis chromatographie sur colonne, on récupère le composé [4] (C8H8O2). 43- Proposer un mécanisme de l'étape d'hydrolyse. Quel sous-produit organique est-il formé ? Le spectre RMN 1H de [4] (C8H8O2) enregistré dans CDCl3 avec un spectromètre (300 Page 15/21 Tournez la page S.V.P. Chimie 2012 Filière PC MHZ) présente les pics suivants (s=singulet, d=doublet) .' 9,89 (s, 1H) ; 7,85 (d, 2H) ; 7,01 (d, 2H) ; 3,90 (s, 3H). 44- Quel est le nombre d'insaturations de [4] ? Analyser le spectre RMN du composé [4]. Synthèse du précurseur [7]. Le précurseur [7] est obtenu en trois étapes a partir de l'acide 3,5--dihydroxybenzoi'que. HO NaOH/Mezso4, H20 LiAIH4 PBr3 COOH _» [5] --> [6] --> [7]
Et0H CH2CI2
H0
45- Donner une forme de Lewis du diméthylsulfate Me2804. Montrer que les atomes
de
carbone de ce composé sont électrophiles.
46- Nommer la réaction qui conduit à [5], donner la structure de [5]. Combien
d'équivalents de soude et de diméthylsulfate doit-on introduire ?
47- Donner la formule de [6].
48- Donner la formule de [7].
Couplage des deux précurseurs [4] et [9].
La synthèse se termine en faisant réagir le composé [4] avec un composé [9]
obtenu a partir
de [7], selon le schéma .'
P(OEt)_, NaH +[4] i)BBr,/CH,Cl,
[7]--_>[81----> [9] ----> [10] ----> resvératrol
130°C THE - 10°C THF, 0°C 2)H30+/H20
Page 16/21
Chimie 2012 Filière PC
49-
Montrer que le triéthylphosphite (P(OEt)3) est un réactif nucléophile. Donner la
formule développée de [8].
50-
Quel est l'atome d'hydrogène acide de [8]? Pourquoi utiliser une base aussi
forte que
NaH ? Donner la formule développée de [10]. Pourquoi en début de synthèse
a-t-on protégé
tous les groupements hydroxyle ?
51-
En vous aidant du mécanisme de la réaction de Wittig, donner celui conduisant à
[10].
52-
Expliquer comment se fait ensuite la déprotection des groupements hydroxyle pour
obtenir le resvératrol: quel est son principe moteur ?
H- Activité anti-oxydante du resvératrol
Cas des phénols. Les phénols sont très facilement oxydés par les oxydants
n'échangeant
qu'un seul électron, par exemple, les ions Fe3+. Cette réaction est
cinétiquement favorisée par
la formation au cours du mécanisme d'un radical stabilisé par résonance. Comme
la
cinétique de couplage radicalaire est rapide, on observe, à la fin de la
réaction, la formation
de dérivés biphényle, c'est-à-dire la formation d'une liaison carbone-carbone
entre deux
groupes phényle.
53-
Donner la réaction équilibrée de la formation du radical PhO· par réaction du
phénol
et de l'ion Fe3+ . Donner la structure d'un des composés biphényle que l'on
peut obtenir.
Cas des diphénols ortho ou para. Si l'on utilise un diphénol possédant des
groupements
hydroxyle en position ortho et para, les composés biphényle ne sont pas obtenus.
Si on part de l'hydroquinone (YH2 :1,4-dihydroxybenzène), on obtient un composé
OX
oxydé, mais non radicalaire.
Le diagramme potentiel-pH d'un mélange équimolaire de OX et YH2 est donné
ci-après.
Page 17/21
Tournez la page S.V.P.
Chimie 2012 Filière PC
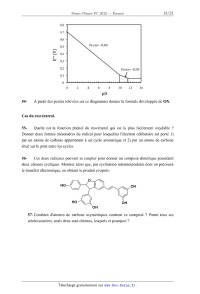
E'° (V)
54- A partir des pentes relevées sur ce diagramme donner la formule développée
de OX.
Cas du resvératrol.
55- Quelle est la fonction phénol du resvératrol qui est la plus facilement
oxydable ?
Donner deux formes mésomères du radical pour lesquelles l'électron célibataire
est porté 1)
par un atome de carbone appartenant à un cycle aromatique et 2) par un atome de
carbone
situé sur le pont entre les cycles.
56- Ces deux radicaux peuvent se coupler pour donner un composé dimérique
possédant
deux cétones cycliques. Montrer alors que, par cyclisation intramoléculaire
dont on précisera
le transfert électronique, on obtient le produit ci-après:
57- Combien d'atomes de carbone asymétriques contient ce composé ? Parmi tous
ses
stéréoisomères, seuls deux sont obtenus, lesquels et pourquoi ?
Page 18/21
Chimie 2012 Filière PC
1- Synthèse d'un dérivé du resvératrol
La solubilité du resvératrol est faible en milieu aqueux (par exemple a 20°C .'
s20=3,2.10'5
mol/L) et il ne passe pas la barrière cellulaire, d'où l'impossibilité
d'apporter dans la cellule
son pouvoir anti--oxydant, la où l'activité anti--cancéreuse du composé est
attendue. Pour
surmonter cette dijficulté, une idée consiste a introduire sur le resvératrol
un cation
triphénylphosphonium qui facilite le passage de la paroi membranaire.
: Cl K;CÛ_; Nal ACCl PPh,
Rcsvcratrol + Br/W -->|11|__}|121--'> [131--) IM]
DMF, T.....h Acétone Pyridinc 'I'oluènc
reflux CH;C'l; reflux
Le resvératrol possède trois pKa de valeurs 8,8; 9,9 et 11,4. Pour (C02,H20) :
pKa; = 6,4;
pKa; = 10,3.
58- Dans le resvératrol, quel est l'atome d'hydrogène le plus acide, pourquoi ?
En
supposant que les pKa sont peu modifiés dans le DMF (diméthylformamide :
solvant),
donner l'espèce ionique majoritaire après la réaction acide--base entre le
resvératrol et un
équivalent d'ions carbonate.
59- Donner le type de réaction entre l'espèce ionique formée par réaction
acide--base et le
1--bromo--4--chlorobutane. Le composé [11] contient encore un halogène, lequel
et pourquoi ?
La seconde étape porte de nom de réaction de Finkelstein, elle utilise la
grande difi'érence de
solubilité des halogénures de sodium dans l'acétone.
solubilités massiques dans l'acétone (g/L) : NaCl : 5,6.10"6; NaBr : 0,095 ;
Nal : 247.
60- Donner une interprétation qualitative de cette grande différence de
solubilité.
61- Donner la formule de [12] en précisant le type de réaction que l'on vient
d'effectuer.
Expliquer pourquoi la méthode de Finkelstein la rend très favorable.
62- Equilibrer l'équation de la réaction conduisant à [13]. Peut--on travailler
avec un grand
excès de AcCl (abréviation de CH3COCI ) ? Quel est le rôle de la pyridine ?
63- Le composé [14] est un sel qui contient le cation triphénylphosphonium,
donner sa
formule.
Page 19/21 Tournez la page S.V.P.
Chimie 2012 Filière PC
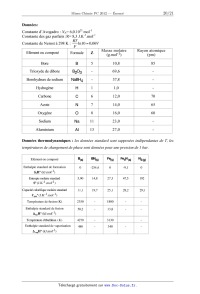
Données:
Constante d'Avogadro : NA= 6,0.1023 mol-1
Constante des gaz parfaits :R= 8,3 J.K-1.mol-1
RT
Constante de Nernst à 298 K :
ln10 = 0,06V
F
Elément ou composé
Masse molaire
(g.mol-1)
Rayon atomique
(pm)
Formule
Z
Bore
B
5
10,8
85
Trioxyde de dibore
B2O3
-
69,6
-
Borohydrure de sodium
NaBH4
-
37,8
-
Hydrogène
H
1
1,0
-
Carbone
C
6
12,0
70
Azote
N
7
14,0
65
Oxygène
O
8
16,0
60
Sodium
Na
11
23,0
-
Aluminium
Al
13
27,0
-
Données thermodynamiques : les données standard sont supposées indépendantes de
T, les
températures de changement de phase sont données pour une pression de 1 bar.
Elément ou composé
B(s)
BN(s)
Fe(s)
Fe4N (s)
N2 (g)
Enthalpie standard de formation
! H° (kJ.mol-1)
0
-254,4
0
-9,1
0
Entropie molaire standard
S° (J.K-1.mol-1)
5,90
14,8
27,3
47,5
192
Capacité calorifique molaire standard
C ° (J.K-1.mol-1)
11,1
19,7
25,1
28,2
29,1
Température de fusion (K)
2350
-
1800
-
-
Enthalpie standard de fusion
! H° (kJ.mol-1)
50,2
-
13,8
-
-
Température d'ébullition (K)
4270
-
3130
480
-
340
f
p,m
fus
Enthalpie standard de vaporisation
! H° (kJ.mol-1)
vap
Page 20/21
-
-
Chimie 2012 Filière PC
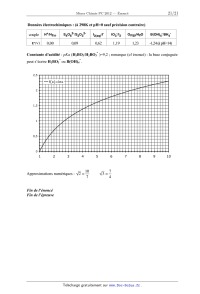
Données électrochimiques : (à 298K et pH=0 sauf précision contraire)
couple
E°(V)
H+/H2(g)
S4O62-/S2O32-
I2(aq)/I-
IO3-/I2
O2(g)/H2O
B(OH)4-/BH4-
0,00
0,09
0,62
1,19
1,23
-1,24 (à pH=14)
-
Constante d'acidité : pKa (H3BO3/H2BO3 )=9,2 ; remarque (cf énoncé) : la base
conjuguée
-
-
peut s'écrire H2BO3 ou B(OH)4 .
2,5
f(x)=lnx
2
1,5
1
0,5
0
1
2
3
Approximations numériques :
4
2"
5
10
7
6
3"
7
8
9
10
7
4
Fin de l'énoncé
Fin de l'épreuve
Page 21/21
Tournez la page S.V.P.