Mines Chimie PC 2004
| Thème de l'épreuve | Étude de l'élément cobalt. Synthèse du 7,20-diisocyanoadociane. |
| Principaux outils utilisés | cristallographie, oxydoréduction, champ cristallin, potentiel chimique, chimie organique, orbitales moléculaires |
Corrigé
: 👈 gratuite pour tous les corrigés si tu crées un compte👈 l'accès aux indications de tous les corrigés ne coûte que 5 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)












Rapport du jury
(télécharger le PDF)


Énoncé obtenu par reconnaissance optique des caractères
ÉCOLE NATIONALE DES PONTS ET CHAUSSÉES.
ECOLES NATIONALES SUPERIEURES DE L'AÉRONAUTIQUE ET DE L'ESPACE,
DES TECHNIQUES AVANCÉES, DES TELECOMMUNICATIONS,
DES MINES DE PARIS, DES MINES DE SAINT-ÊTIENNE, DES MINES DE NANCY,
DES TELECOMMUNICATIONS DE BRETAGNE. '
ECOLE POLYTECHNIQUE (Filière TSI).
CONCOURS D'ADMISSION 2004
ÉPREUVE DE CHIMIE
Filière : PC
Durée de l'épreuve : 4 heures
L'usage d'ordinateur ou de calculatrice est interdit
Sujet mis àla disposition des concours : Cycle International, EN STIM, TPE-EIVP.
Les candidats sont priés de mentionner de façon apparente sur la première page
de la copie :
CHIMIE 2004-Filière PC
Cet énoncé comporte 16 pages de texte.
Si, au cours de l'épreuve, un candidat repère ce qui lui semble être une erreur
d'énoncé, il le signale sur sa
copie et poursuit sa composition en expliquant les raisons des initiatives
qu'il est amené à prendre.
DÉBUT DE L'ÉNONCÉ
PARTIE A : LE COBALT _
Le cobalt Co (Z = 27) est un élément en faible abondance dans la croûte
terrestre (teneur moyenne voisine de
10 ppm -- parties par millions). À l'état naturel, il est associé sous forme
oxydée à d'autres éléments, comme le
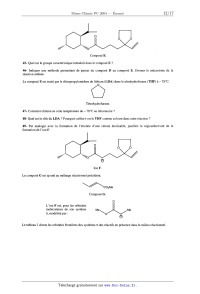
cuivre (sous forme d'oxydes) dans les minerais du Zaïre et de Zambie, le nickel
dans les minerais de Nouvelle-
Zélande, ou à l 'arsenic sous forme d'arséniures (comme dans la smaltite de
formule CoAs2 ).
Il a été isolé à l'état métallique par Georg Brandt en 1735. Son intérêt est
apparu aux métallurgistes dès 1910
quand il a été mis en évidence qu 'il améliorait les aciers à coupe rapide.
Le cobalt est essentiellement un co-produit des productions de cuivre (pour
environ 55 % de la production
mondiale) et de nickel (pour 40 % de la production mondiale). En 1995 il a été
produit environ 20 000 tonnes de
ce métal. Il faut noter que le recyclage contribue pour une grande part (pour
plus de 20 % aux États-Unis ) à sa
production.
Les secteurs d'utilisation sont les « superalliages » (alliages réfractaires
pour turbines à gaz et turbo-réacteurs
dans l'aéronautique, contenant 20 % en masse de cobalt), les aimants (comme les
aimants Al-Ni-Co, utilisés
dans les systèmes de freinage ABS), les alliages durs (utilisés notamment dans
la robinetterie électro--nucléaire,
en particulier dans le circuit primaire des réacteurs à eau sous pression), la
céramique (sous forme d'oxydes
colorés comme C0304) et la chimie (notamment sous forme de complexes neutres,
catalyseurs de nombreux
procédés chimiques). Les isotopes radio-actifs comme le 60Co sont utilisés en
radio-thérapie et radiographie
industrielle.
Le cobalt est un oligo-élément qui intervient dans des processus métaboliques.
Il est un des constituants de la
vitamine BIZ.
ERRATA
sujet de chimie en PC :
Page 9, entre les questions 38 et 39, au lieu de
"A réagit sur le (-)--menthol à 9 °C, sans catalyseur, pour donner un
composé B."
lire _
"A réagit sur le (-)-menthol à 90 °C, sans catalyseur, pour donner un
composé B."
Page 16, dernier tableau, remplacer (deux fois) le mot << Fréquence >>
par << Nombre d'onde >>.
Ce problème s'intéresse à de nombreux aspects de la chimie des composés du
cobalt. Nous passerons en revue la
structure du cobalt métallique, l'étude de l'oxyde de cobalt(ll), composé « non
stoechiométrique », la préparation,
la structure et l'analyse de complexes du cobalt(lIl).
Les différentes parties sont totalement indépendantes. Au sein de chacune
d'elles, de nombreuses
questions sont indépendantes et la réponse à fournir est souvent brève.
Il est précisé qu'aucune connaissance particulière sur la chimie du cobalt
n'est nécessaire pour la résolution des
questions posées.
Données numériques (les valeurs numériques ont été arrondies) :
Pression standard : P° : 1,00 bar : 1,00. 105 Pa.
Concentration molaire standard : c° : 1,00 mol.L".
Constante des gaz parfaits : R = 8,3 J.K"Ïmol".
a=BËT--'1mo=o,osv , F étant la constante de Faraday.
Numéros et masses molaires atomiques :
Rayons ioniques et/ou atomiques :
Tec : 125 pm rC°2+ : 79 pm rCo3+ : 69 pm r02-- : 126 pm
Potentiels standard d 'oxydoréduction E° (V) à T = "298 K et à pH : 0 :
Co(C204)33" / Co(CZO4)34' s.,oä*' / 52032" 131302 / Pb2+ MnO4 /Mn2+ CO2 / H2C204
E°1=057V E°2=052V E°3=0,08V E°6=1,45V E°7= 1,51 v Eog__060v
pKA des couples acide-base, à T = 298 K :
H2C204 / HC204-- HC204_ / C2042-- COz(ûQ) / HCO3-- HCO3-- / C032-- H3CC02H /
H3CCOZ--
I L'élément et le corps simple
1-- Donner la configuration électronique de l'atome de cobalt, de l'ion Co2+ et
de l'ion Co3+ dans leur état
fondamental.
2- Le cobalt métallique, à une température supérieure à 500°C, cristallise dans
la structure cubique faces
centrées. La masse volumique du corps simple est: p : 8,8.103 kg.m"3. Dessiner
clairement la maille
conventionnelle de la structure cristalline du cobalt. Montrer comment cette
structure peut être décrite par un
empilement de plans de compacité maximale.
3- Calculer la valeur théorique de la compacité du cristal et donner
l'expression du paramètre de maille, a, en
fonction de la masse volumique p.
Il L'oxyde de cobalt(ll) : un composé non stoechiométrique
À température élevée, en présence de dioxygène 02, l'oxyde de cobalt(ll) COO
est un composé non
stoechiométrique, semi-conducteur de type p. On se propose de rendre compte de
ces propriétés.
4-- La structure cristalline de l'oxyde de cobalt stoechiométrique est du type
NaCl. Représenter la maille
conventionnelle de la structure cristalline de COO.
5- Vérifier la compatibilité des valeurs des rayons ioniques des 10ns Co2+ et
02 avec la structure de l'oxyde. La
réponse devra être justifiée.
Données: J£=1,41,Jä=1,73.
Pour une pression partielle de dioxygène supérieure à 10"3 P°, les résultats
expérimentaux montrent que la non--
stoechiométrie de l'oxyde de cobalt résulte uniquement de la formation de «
lacunes de cobalt simplement
ionisées >>. Il est commode de représenter les éléments de structure dans la
notation de Krôger--Vink qui est
précisée ci-après :
Les ions cobalt(ll) et oxyde en position normale dans les sous-réseaux
cationique et anionique sont notés
respectivement CoË0 et 02. La croix en exposant indique que la charge effective
qe de cet élément de
structure (définie comme la différence entre la charge qr de l'espèce qui
occupe réellement le site et la
charge qn de l'espèce qui devrait l'occuper dans la structure idéale : qe : qr
---- q,,) est nulle.
Une lacune en ion cobalt, résultant du départ du cristal d'un ion Co2+ du
sous--réseau cationique, est
notée VCo (abréviation de vacancy qui, en anglais, signifie lacune). La double
apostrophe en exposant
indique que la lacune porte une charge effective égale a (--2e), résultant de
la déficience d' une charge
(+2e) par rapport à la charge de l'espèce Coz+ devant normalement occuper le
site.
Ces lacunes peuvent être éventuellement porteuses de charges. Tel est le cas de
l'oxyde de cobalt étudié,
pour lequel il se forme des « lacunes de cobalt simplement ionisées », pour
laquelle la notation est VCO .
L'apostrophe unique indique la présence, pour cet élément de structure, d'une
charge effective égale à
(--e), résultant de la déficience d'une charge (+e) par rapport à la charge
d'un ion Co2+ devant
normalement occuper le site.
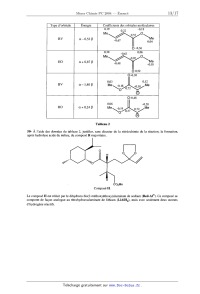
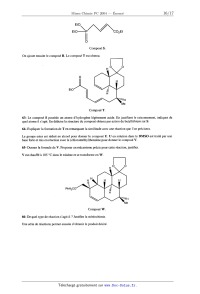
Il peut aussi se former des << défauts électroniques de charge positive », résultant de la perte d'un électron par des éléments de structure du sous--réseau cationique. Dans le cas de l'oxyde de cobalt, un ' / , \ ° -- , . . . . ion Co2+ ayant perdu un electron, c est-a--d1re un lon Co", est note CoCo , le Signe ' md1quant que cet élément de structure possède une charge effective (+e), résultant de la déficience d' une charge (--e) par rapport à l'ion Co2+ devant occuper normalement ce site. Le cristal idéal, stoechiométrique, est noté « 0 ». 6- Écrire, dans la notation de Krôger-Vink, l'équation de la réaction quasi--chimique notée ( l) traduisant la formation du cristal non stoechiométrique à partir de dioxygène et du cristal idéal stoechiométrique avec la mise en place d'un ion oxyde en surface et création concomitante d'une lacune VCo et d'un défaut électronique de charge positive Coè0 . Le nombre stoechiométrique du dioxygène sera pris égal à 1/2. La thermodynamique statistique permet de définir un potentiel chimique pour chacun des éléments de structure de l'oxyde non stoechiométrique, y compris les lacunes. Nous considérons que les éléments de structure (autres que les éléments normaux CoËo et 023) sont en quantité suffisamment faible dans le cristal pour que le potentiel chimique de ces espèces prenne l'expression suivante, valable en solution infiniment diluée : uk = @... + RT ln xk expression dans laquelle xk désigne la fraction molaire de l'élément de structure. Compte tenu de la faible valeur de cette grandeur, xk peut être assimilée au rapport de la quantité de matière d'élément de structure et de la "k quantité de matière de cristal : xk : nCoo Le potentiel chimique des éléments de structure normaux est pris égal au potentiel chimique standard correspondant, ce qui revient à dire que les éléments normaux de structure constituent le « solvant » des éléments non normaux. Le dioxygène est assimilé à un gaz parfait. Notons K1° la constante thermodynamique de l'équilibre (l). 7- Rappeler la définition de l'état standard d'un solvant. Par analogie avec l'état standard d'un soluté en solution aqueuse, définir l'état standard d'un soluté, compte tenu de l'expression ci--dessus. 8- Rappeler l'expression du potentiel chimique d'un gaz parfait. 9- Exprimer la condition d'équilibre quasi chimique entre le cristal et le dioxygène, traduite par l'équation (l). . . . . . . , , . . . En déduire la relation entre les fractions molaires des lacunes ionisées VCo , des cations CoCO et la pressmn partielle du dioxygène, lorsque l'équilibre est établi. 10- Quelle relation supplémentaire est-il possible d'écrire entre les fractions molaires des lacunes ionisées VCo - . ; - , . . . . . , . . et des cations CoCo ? En dedu1re 1 expres51on de la fraction molaire en lacune ionisee en fonction de la presswn partielle de dioxygène, lorsque l'équilibre entre le cristal et le dioxygène est établi. 11- La conductance du cristal, semi-conducteur de type p, est proportionnelle à la fraction molaire en cations . . , . , . . , . . , . COCO. Proposer, a l'aide d'un schema Simple, un mécanisme de conduction de l'electr1c1te dans le cristal non stoechiométrique en équilibre avec le dioxygène. La variation de la masse du cristal à l'équilibre avec la pression partielle de dioxygène, pour des valeurs de la température comprises entre 1000 °C et 1200 °C, sous une pression de dioxygène comprise entre 10"3 P° et P°, a été étudiée par N.G. Eror et J.B. Wagner (J. Phys. Chem. Solids, 1968). Les résultats sont rassemblés sur la figure 1. Nous allons montrer que ces résultats sont en accord avec le modèle précédent. 12- Notons ms la masse d'un échantillon du cristal stoechiométrique (sous une pression partielle de dioxygène égale à 0) et m... la masse du même échantillon en équilibre avec le dioxygène à la pression partielle P. Etablir la . . . ' . . . relation entre la fraction molaire en lacune VCD et les masses ms et m.... On mtrodu1ra les masses molaires de l'oxygène et de l'oxyde de cobalt, respectivement MO et MCoO- 13- En déduire la relation liant les masses m... et ms à la pression de dioxygène. Le modèle proposé rend-il compte des résultats expérimentaux dans le domaine de pression étudié ? 14- Montrer que l'on peut déduire des résultats expérimentaux présentés les valeurs de K.° pour les températures 0 et 0' ainsi que l'enthalpie standard de la réaction (1), en supposant que cette grandeur est constante dans l'intervalle de température étudié. Aucune valeur numérique n'est exigée. 15- La formule de composition du cristal non stoechiométrique peut se mettre sous la forme Col_pO. Indiquer en fonction de p les quantités de matière de tous les éléments de structure présents dans un échantillon d'une mole de cristal non stoechiométrique. 0,871 0,8708 0,8706 0,8704 0,8702 0,87 0 0,2 0,4 0,6 0,8 1 Figure 1 -- Évolution de la masse d'un échantillon en fonction de la pression en dioxygène III Complexes du cobalt(Ill) L'étude des complexes du cobalt{ III ) a permis & Werner et Jorgensen de mettre en place, dans les années 1890 -- 1930, l'essentiel des connaissances sur la structure des ions complexes et leur mode de réactivité. En effet, les complexes du cobalt( III ) sont excessivement nombreux et souvent très stables en solution aqueuse. La vitesse d'échange entre ligands est, à ce propos, souvent très faible, ce qui a permis de préciser les mécanismes de ces réactions. Dans la très grande majorité de ces complexes, l'ion cobalt( III ) a un environnement de type octaédrique, ce qui induit des propriétés stéréochimiques intéressantes. III-1 Structure d'ions complexes du cobalt(Ill) 16- Rappeler en quelques lignes le principe de la théorie du champ cristallin appliquée aux ions complexes des métaux de transition. Tracer qualitativement le diagramme d'énergie des orbitales 3d du cobalt dans un environnement octaédrique. 17 - Représenter, sur le diagramme précédent, les deux possibilités de remplissage électronique des niveaux pour un complexe octaédrique de l'ion Co". 18-- La très grande majorité des complexes de l'ion Co3+ sont diamagnétiques. Qu'est--il possible d'en déduire ? 19- Les ions oxalate C2042' forment avec les ions Co3+ l'ion complexe Co(CZO4)33" de structure octaédrique. Donner le nom de ce complexe en nomenclature systématique. 20- Représenter dans l'espace cet ion complexe. Montrer qu'il est chiral. Combien possède-t--il de stéréo-- isomères de configuration ? Quelle est la nature de la stéréoisomérie de configuration ? 21- Les deux énantiomères de ce complexe ont pu être séparés par précipitation fractionnée avec un composé bien choisi, organique ou non. Rappeler en quelques lignes (5 maximum) le principe de la séparation de deux énantiomères. Remarque : la séparation des énantiomères de tels ions complexes a permis à Werner d 'apporter la preuve de l'environnement octaédrique dans les complexes et de montrer que la chiralité moléculaire pouvait être observée en l'absence d'atomes de carbone asymétriques. III-2 Préparation et analyse d'un complexe du cobalt Dans cette partie, la synthèse et l'analyse du complexe Co(CZO4)33' sont étudiées. III--2-l Mode opératoire de synthèse Le mode opératoire suivant est proposé : a. Dans un bécher contenant 100 mL d'eau, introduire une masse m1 = 5,0 g d'acide oxalique (sous forme de cristaux de formule {HZCZO4, 2 H20} et une masse m2 = 15 g d'oxalate de potassium (sous forme de cristaux de formule {KZCZO4, H20}. Chauffer jusqu'à obtention d'une solution limpide. b. Ajouter alors une masse m3 = 4,8 g de carbonate de cobalt (sous forme de cristaux de formule COCO3). Observer un dégagement gazeux. Agiter jusqu'à obtention d'une solution limpide. c. Sous agitation vigoureuse, ajouter alors une masse m4 = 4,8 g de dioxyde de plomb (sous forme de cristaux de formule Pb02), puis un volume V5 = 5 mL d'acide éthanoïque H3CCOOH pur. d. Agiter pendant une heure, période au cours de laquelle la solution passe du rouge au vert intense. e. Éliminer par filtration l'excès éventuel de dioxyde de plomb, puis refroidir le filtrat dans un bain d'eau glacée et ajouter de l'éthanol jusqu'à ce qu'un solide vert précipite. f. Laisser reposer à froid jusqu'à cristallisation complète, puis collecter le solide par filtration sous pression réduite. g. Laver le solide avec de l'éthanol refroidi, puis essorer le solide. Sa masse est m6 = 14,0 g. Les valeurs des différentes quantités de matière sont rassemblées dans le tableau ci-dessous. Réactif uantité de matière {H2C204, 2 H20} nl = 0,040 mol {chzo4, H20} n2=0,080 mol COC03 m = 0040 mol Pbo2 n4 : 0,020 mol H3CCOOH n5 z 0,085 mol 22- Quelle est la nature du dégagement gazeux observé au point b ? Justifier la réponse. En déduire l'équation de la réaction conduisant des réactifs utilisés aux ions Co(CZO4)34Î 23- Quel est le rôle du dioxyde de plomb ? Écrire l'équation de la réaction entre les ions Co(CZO4)34' et le dioxyde de plomb en milieu acide. 24- Calculer la valeur de la constante thermodynamique de cet équilibre. Qu'est-il possible de déduire du résultat obtenu ? 25- Commenter les proportions de réactifs utilisées. III-2-2 Analyse du solide Le mode opératoire suivant, permettant dans un premier temps le dosage des ions oxalate puis celui des ions cobalt contenus dans le solide, est proposé. h. Dans un erlenmeyer, introduire une masse de solide m, précisément connue, voisine de 0,9 g. Ajouter 50 mL d'eau, puis 5 mL d'une solution d'hydroxyde de sodium de concentration molaire voisine de 2 mol.L"'. i. Chauffer à ébullition, puis filtrer sur papier filtre. Rincer le solide avec de l'eau chaude. Rassembler les phases aqueuses. j. Refroidir la phase aqueuse, puis la transférer quantitativement dans une fiole jaugée de 0,1000 L et compléter au trait de jauge. La solution (S) est obtenue. k. Dans un bécher, introduire un volume V = 25,00 mL de la solution (S). Ajouter un volume d'environ 50 mL de solution d'acide sulfurique de concentration molaire voisine de 2 mol.L"'. Porter à la température de 60 °C. ]. Sous agitation, titrer par une solution étalonnée de permanganate de potassium de concentration molaire égale à of. La solution se colore en violet pour un volume de titrant ajouté égal à V8. m. Transférer le papier filtre (point i du protocole) et son contenu dans un bécher. Ajouter un volume d'environ 50 mL de solution d'acide sulfurique de concentration molaire voisine de 2 mol.L"', puis introduire une masse m8 = 1,7 g d'iodure de potassium solide. Agiter et observer la dissolution progressive du solide, ainsi que l'apparition d'une coloration marron intense. n. Laisser reposer 30 minutes, puis titrer la solution obtenue par une solution étalonnée de thiosulfate de sodium de concentration molaire égale à c'T. Lorsque le contenu du bécher est jaune très pâle, ajouter un peu d'empois d'amidon et poursuivre le-titrage jusqu'à décoloration complète. Le volume de solution titrante ajouté est alors V9. Dosage des ions oxalate : 26- Le diagramme potentiel-pH du cobalt, limité aux espèces usuelles en solution aqueuse, est représenté sur la figure 2. Il est tracé pour une concentration totale en cobalt dissous égale à 1,010"2 mol.L"'. Les espèces envisagées sont le métal Co, les ions Co" et Co", les solides Co(OH)2 et Co(OH):,. En justifiant le raisonnement tenu, attribuer aux diverses espèces les différents domaines délimités par les courbes tracées. Préciser s'il s'agit de domaines d'existence ou de domaines de prédominance. 2,5 E (V) 2 1,5 0 2 4 6 8 10 12 14 Figure 2 -- Diagramme potentiel--pH du cobalt 27- Quelle est la nature du solide obtenu au point i du protocole ? Justifier la réponse. Écrire l'équation de la réaction de formation de ce solide à partir des réactifs apportés. 28- Ecrire l'équation de la réaction entre les ions oxalate et les ions permanganate, en milieu acide. Que peut-on dire de cette réaction ? 29- Des résultats expérimentaux, déduire la quantité de matière d'ions oxalate présente dans l'échantillon de masse m. Elle sera exprimée sous forme littérale à l'aide de cT et V3. Dosage du cobalt : 30- Quelle est la nature de l'espèce chimique responsable de l'apparition de la coloration marron intense (point m du protocole) ? Ecrire l'équation de la réaction de formation de cette espèce à partir des réactifs apportés. 31- Sur quelle base est choisie la valeur de la quantité d'iodure de potassium apportée ? Comment est--il possible de vérifier expérimentalement que la quantité apportée est convenable ? 32- Quel est l'intérêt d'ajouter de l'empois d'amidon en fin de titrage (point 11 du protocole) ? . 33- Des résultats expérimentaux, déduire la quantité de matière nCo de cobalt présente dans l'échantillon de masse m. Elle sera exprimée sous forme littérale à l'aide de c'T et V9. 34- En fait, le solide obtenu dans le papier filtre (point i du protocole) est l'oxyde de cobalt(llI) de formule C0203. Cela modifie-t-il les conclusions précédentes ? 35- Application numérique: CT : 0,0200 -mol.L'l, c'T : 0,0500 mol.L"', m = 0,880 g, V8 = 29,8 mL, V9 = 40,1 mL. Vérifier la cohérence des résultats avec la formule annoncée du complexe. Proposer alors une formule pour le composé solide obtenu au point g du protocole. Ce problème a été conçu d'après la synthèse réalisée par E.] . Corey et P.A. Margriotis en 1986 de ce produit naturel (JACS, 1987, 109, 287). --uIIIIIH Me Formule topologique du 7,20-diisocyanoadociane Cette synthèse utilise le (-)-menthol composé naturel, dont la formule est la suivante : 36- Représenter les conformations chaise de cette molécule. Indiquer la conformation la plus stable, justifier. 37- Établir la configuration absolue des atomes de carbone asymétriques de cette molécule. Expliquer le raisonnement. On va faire réagir le (-)-menthol sur un composé A, de formule brute C5H603, dont on va établir la structure. Le spectre RMN du proton du composé A présente un quintuplet à 1,95 ppm, d'intensité relative l, et un triplet à l 2,75 ppm d'intensité relative 2. A ne présente pas d'absorption infrarouge significative au--dessus de 3000 cm_ , et possède deux bandes d'absorption relativement intenses vers 1750 et 1800 cm_l. 38- Trouver la formule développée de A, en indiquant le raisonnement complet. A réagit sur le (-)-menthol à 9 °C, sans catalyseur, pour donner un composé B. 39- Donner la formule développée de B. Donner le mécanisme de la réaction. B est transformé en composé C de formule : Composé C. 40- Donner une méthode pour obtenir le composé C à partir de B (le mécanisme et les conditions opératoires ne sont pas demandés). On fait réagir l'organométallique (n-Bu)3Sn--CH=CH2 sur C en proportions équimolaires, en présence d'un catalyseur, Pd(P(C6H5)3)4. Le composé D, très majoritaire, est obtenu avec un rendement de 90% : / Composé D. Pour rendre compte de la régiosélectivité de la réaction, on étudie les orbitales frontières des réactifs, la réaction étant sous contrôle orbitalaire. La fonction chlorure d'acer du composé C est modélisée par le fragment : La fonction ester du composé C est modélisée par le fragment : Me\ 0 Me/"\Cl o O/"\ 0 Me La fonction énone du composé D est modélisée par le fragment : / Me Le tableau 1 donne les orbitales frontières des fragments précédents. 41- Déduire du tableau 1 les orbitales frontières du système % du composé C. 42- Rappeler quels sont les produits de la réaction (après hydrolyse du milieu réactionnel) d'un organomagnésien, sur un chlorure d'acyle, et sur un ester. Donner le mécanisme schématique de chaque réaction. Type d'orbitale Coeffic1ents des orbitales molecula1res Basse vacante Haute occupée Tableau 1 En première approximation, l'organo--stanneux réagit de manière analogue au nucléophile : H H\y/l/9 H 43- À l'aide des questions précédentes, interpréter la formation du composé D. 44- À l'aide des données du tableau 1, comparer la réactivité de C et de D vis--à-vis d'un nucléophile. Ce résultat est--il compatible avec la formation quasi--exclusive de D dans l'expérience ? Proposer une explication qualitative. Le composé D est transformé en composé E : Composé E. 45- Quel est le groupe caractéristique introduit dans le composé E ? 46- Indiquer une méthode permettant de passer du composé D au composé E. Donner le mécanisme de la réaction utilisée. Le composé E est traité par le diisopropylamidure de lithium (LDA) dans le tétrahydrofurane (THF) à --- 78°C. 0 Tétrahydrofurane. 47 - Comment obtient-on cette température de -- 78°C au laboratoire ? 48-- Quel est le rôle du LDA ? Pourquoi utilise-t-on le THF comme solvant dans cette réaction ? 49- Par analogie avec la formation de l'énolate d'une cétone énolisable, justifiez la régiosélectivité de la formation de l'ion F. Ion F. Le composé G est ajouté au mélange réactionnel précédent. \/\cone Composé G. L'ion F est, pour les orbitales moléculaires de son système Me Me 11:, modélisé par : \O @ Le tableau 2 donne les orbitales frontières des systèmes % des réactifs en présence dans le milieu réactionnel. T e d'orbitale Coefficients des orbitales moléculaires Tableau 2 50- À l'aide des données du tableau 2, justifier, sans discuter de la stéréochimie de la réaction, la formation, après hydrolyse acide du milieu, du composé H majoritaire. H C02M9 Composé H. Le composé H est réduit par le dihydruro-bis(2-méthoxyéthoxy)aluminate de sodium (Red-Al®). Ce composé se comporte de façon analogue au tétrahydruroaluminate de lithium (LiAlH4), mais avec seulement deux atomes d'hydrogène réactifs. NS'9 \? H/ \OXO/ Dihydruro-bis(2-méthoxyéthoxy)aluminate de sodium (Red-Al®). H o_/_O\ / 51- En utilisant les résultats de la question 42, expliquez le passage du composé H à l'alcoolate ]. Alcoolate ]. 52- Pourquoi ne pas avoir utilisé directement LiAIH4 pour effectuer la réaction précédente ? Après protonation, I donne J qui est purifié. J est traité par le tert--butylchlorodiméthylsilyle (TBDMSCI) en solution dans le dichlorométhane, en présence de triéthylamine et de 4-(N,N--diméthyl)aminopyridine (DMAP). On rappelle que l'ion chlorure constitue un bon nucléofuge. Il se forme alors le composé K. Me\N/Me T° / t--Bu--Si--CI | \ Me N TBDMS--Cl DMAP 53- Quels sont les sites basiques du DMAP ? Justifier la plus grande basicité de l'atome d'azote intra-cyclique. 54- Quel est le type de réaction mis en jeu dans la formation du composé K ? On raisonnera par analogie avec une réaction connue des alcools. Ecrire la formule semi--développée de K. K est traité par l'aluminohydrure de lithium dans l'éther. Après hydrolyse acide, on obtient un composé L. Celui- ci est opposé au dichromate de pyridinium, réactif présentant le même comportement que le trioxyde de chrome dans la pyridine, mais plus stable. On obtient le composé M, qui présente, dans son spectre RMN du proton, un singulet, d'intégration 1 à 9,8 ppm, et dans son spectre infrarouge, aucune bande d'absorption large au--dessus de 3000 cm_l, une petite bande d'absorption vers 2720 cm_l, une bande intense vers 1730 cm_l. 55- Donner la formule de L. 56- Donner la formule semi-développée de M. Justifier. M réagit avec l'ylure de phosphore N, dans le THF à 0 °C, et donne le composé 0, qui comporte une double liaison de configuration absolue E. Ph /\®/Y""% Ph Ylure de phosphore N. 57- À quelle réaction classique est--il possible de rattacher la formation de O ? Donner la formule topologique de O. 0 est chauffé à 150 °C dans le toluène, et se transforme en P. TBDMSO Composé P. 58- Quelle est la réaction mise en jeu pour effectuer la cyclisation précédente ? Dessiner la molécule 0 avec une formule topologique telle que l'emplacement des divers groupes préfigure la structure de la molécule P. Respecter la stéréochimie. 59- Montrer que la position relative des deux atomes d'hydrogène situés à la jonction des deux cycles correspond bien aux propriétés de la réaction étudiée. Une autre disposition est-elle possible ? 60- Le cycle du (--)-menthol n'apparaît plus dans la molécule de P. Quel a été le rôle du (-)-menthol dans la synthèse et à quelle étape sa présence a--t-elle été décisive ? Justifier qualitativement la réponse. Le groupe TBDMSO est transformé en groupe hydroxyle par l'action du fluorure de tétrabutylammonium en solution dans le THF. Le composé Q est alors formé. 61- Quel a été le rôle du TBDMSCI dans cette synthèse ? On utilise à nouveau le dichromate de pyridinium pour le faire réagir sur Q. R est alors formé. 62- Donner la structure de R. On fait réagir le butyllithium dans le THF à -- 78 °C sur le composé S. EtO\ /\/\ O Composé S. On ajoute ensuite le composé R. Le composé T est obtenu. EtO Composé T. 63- Le composé S possède un atome d'hydrogène légèrement acide. En justifiant le raisonnement, indiquer de quel atome il s'agit. En déduire la structure du composé obtenu par action du butyllithium sur S. 64- Expliquer la formation de T en remarquant la similitude avec une réaction que l'on précisera. Le groupe ester est réduit en alcool pour donner le composé U. U en solution dans le DMSO est traité par une base forte et mis en réaction avec le (chlorométhyl)benzène pour donner le composé V. 65-- Donner la formule de V. Proposer un mécanisme précis pour cette réaction, justifier. V est chauffé à 185 °C dans le toluène et se transforme en W. PhH2CO Composé W. 66- De quel type de réaction s'agit-il ? Justifier la stéréochimie. Une série de réactions permet ensuite d'obtenir le produit désiré. Données de RMN . : 5/..... Éther ROCH2R 3,3 -- 3,9 Acide carboxylique 9,5 -- 14,0 RCOZH Aldéh de RCOH 9,0 -- 10,0 Dérivé d'acide RCH2COZR 2/0 -- 3,0 Déplacements chimiques des protons. L'atome d'hydrogène concerné est indiqué avec une taille plus grosse. Données infrarouge. . FIN DE L'ÉNONCÉ.