e3a Chimie PC 2008
| Thème de l'épreuve | Métallurgie du cobalt. Cinétique de polymérisation du buta-1,3-diène. Synthèse de la cortisone. |
| Principaux outils utilisés | thermochimie, oxydoréduction, courbes intensité-potentiel, cinétique, chimie organique |
Corrigé
: 👈 gratuite pour tous les corrigés si tu crées un compte👈 l'accès aux indications de tous les corrigés ne coûte que 5 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)





Rapport du jury
(télécharger le PDF)


Énoncé obtenu par reconnaissance optique des caractères
CONCOURS ENSAM - ESTP - ARCHIMEDE
Epreuve de Chimie PC
Durée 3 h
Si, au cours de l'épreuve, un candidat repère ce qui lui semble être une erreur
d'énoncé,
d'une part il le signale au chef de salle, d'autre part il le signale sur sa
copie et poursuit sa
composition en indiquant les raisons des initiatives qu'il est amené à prendre.
L'usage de calculatrices estautorisé.
JLS9
CONCOURS ENSAM - ESTP - ARCHIMEDE
Epreuve de Chimie PC
Durée 3 h
o , r o \ 0 O A r I
S}, au cours de l'epreuve, un candidat repere ce qui lun semble etre une erreur
d'enonce,
d une part Il le s1gnale au chef de salle, d'autre part il le signale sur sa
copie et poursuit sa
compos1tnon en indiquant les raisons des initiatives qu'il est amené à prendre.
___--___"...
L'usage de calculatrices estautorisé.
Ce problème est constitué de trois parties totalement indépendantes :
métallurgie
du sulfure de cobalt puis obtention du cobalt par électrolyse (1 e"' partie),
cinétique
de polymérisation du butadiène grâce à l'emploi d'un sel de cobalt comme
catalyseur
(2ème partie), synthèse de la cortisone (3eme partie).
Remarques préliminaires importantes : il est rappelé aux candidat(e)s que
. les explications des phénomènes étudiés interviennent dans la notation au
même titre que
les développements analytiques et les applications numériques ; les résultats
exprimés
sans unité ne seront pas comptabilisés ;
- dans les calculs, les gaz sont assimilés à des gaz parfaits et les phases
solides sont non
miscibles ;
- les composés intervenant dans la synthèse organique sont nommés par une
lettre écrite
entre crochets et en caractères gras : [D] par exemple. Pour alléger
l'écriture, les candidats
peuvent ne faire figurer, lors de la description d'un mécanisme, que la partie
« utile » qui
intervient dans la réaction considérée ;
. les données numériques sont répertoriées à la fin de chaque partie ; ln
désigne le
logarithme népérien et log le logarithme décimal. Les données thermodynamiques
ont servi
à calculer les entha/pies libres standard de réaction fournies dans le texte ;
. un document--réponse sera complété puis remis avec la copie.
Le cobalt --- découvert en 1735 par G. BRANDT -- entre dans la composition de
nombreux
alliages utilisés dans les industries électrique, aéronautique et automobile,
ou d'alliages très durs
pour coupe rapide. Il est employé pour la fabrication d'aimants permanents,
d'alliages réfractaires,
de pigments pour le verre, les céramiques et l'industrie des peintures. Il est
également utilisé
comme catalyseur en chimie organique ainsi que pour la production de la
vitamine 812 dans
l'industrie pharmaceutique.
Tournez la page S.V.P.
PREMIERE PARTIE :
METALLURGIE DU COBALT
Le procédé industriel le plus couramment utilisé pour obtenir le sulfate de
cobalt est le
grillage sulfatant de sulfures tels la cobaltpentlandite C0988 ; ces minerais
renferment l'élément
cobalt, mais aussi les éléments cuivre et fer. Après élimination des autres
éléments, le cobalt est
obtenu par électrolyse.
A la suite d'une première étape de flottation qui augmente les concentrations
en Co, Cu,
Fe, le grillage est réalisé selon un procédé « flash » dans un four rotatif. Le
minerai, préalablement
conditionné sous forme de poudre est introduit en partie haute du four en même
temps qu'un
courant d'air chaud ascendant est injecté latéralement ; l'oxydation se déroule
dans la partie
centrale tandis que les étages inférieurs, munis de buses d'injection
alimentées en dioxyde de
soufre, sont le siège de la transformation des oxydes en sulfates. Ces
opérations demandent un
contrôle précis de la température et des flux de matière afin de maîtriser les
réactions au sein du
four.
A I Grillage sulfatant du sulfure de cobalt
Le gril/age sulfatant du sulfure de cobalt est régi par une réaction globale,
scindée en deux
étapes. La première étape produit l'oxyde de cobalt COO et le dioxyde de soufre
802 selon la
réaction :
2 18 16
"ê'ä' COQSB(s) + 02(g) : "2--5 COO{S) + "2--5 SOZ(g)
pour laquelle l'enthalpie libre standard de réaction s'écrit en fonction dela
température :
A,G°(T) : - 294400 + 44 T (J.mol"' ).
A
Tous les calculs thermodynamiques seront réalisés pour un coefficient
stoechiométrigue du
dioxygène égal à l'unité et dans le cadre de l'approximation d'Ei/ingham.
[A]
A1*a. Cette réaction est-elle endo-- ou exothermique ? Que convient-il d'en
déduire quant au
déroulement de la réaction et au fonctionnement du réacteur ?
A1*b. Exprimer la constante d'équilibre K}, en fonction des pressions
partielles à l'équilibre
p(302)é@| et p(02)éq et de la pression de référence p°= 1 bar, puis calculer
K}, à 950 K.
A1*c. Montrer qu'à l'équilibre chimique à 950 K, le logarithme de la pression
partielle p(SOz)éq
varie de manière affine en fonction du logarithme de la pression partielle
p(02)éq et qu'il
vérifie l'expression : log p(802)éq : a+b log p(Oz)éq, droite qui sera notée A;
déterminer
les constantes a et b.
(les pressions partielles p(802)éq et p(02)éq seront exprimées en bar)
A1*d. Ecrire l'affinité chimique de cette réaction.
Représenter schématiquement la droite A dans un diagramme où log p(SOZ) est
porté en
ordonnées et log p(Oz) en abscisses. En raisonnant à p(SOZ) constant (ou à p(Oz)
constant), déterminer le domaine d'existence de chacun des solides.
La deuxième étape est la sulfatation qui doit être réalisée en dessous dela
température de
décomposition du sulfate en formation. Cette réaction s'écrit :
2 000,3) + 2 so,,g, + cm) =.-- 2 Coso,,s, [B]
pour laquelle l'enthalpie libre standard de réaction s'écrit en fonction dela
température :
A,G°(T) == ---- 707200 + 571 T (J.moi"').
B
A2*a. Calculer la température d'inversion de cet équilibre.
La température de 950 K convient-elle pour réaliser la sulfatation de COO ?
3
A2*b. Exprimer la constante d'équilibre KÊ en fonction des pressions partielles
à l'équilibre
p(SOz)éq et p(Og)ëq et de la pression de référence p°= 1 bar, puis calculer Kg
à 950 K.
A2*c. En déduire, quand l'équilibre est réalisé à 950 K, que la frontière entre
le domaine où règne
la phase oxyde et le domaine de la phase sulfate est une droite, notée B,
d'équation:
log p(802)éq : c + d. log p(02)éq ; déterminer les constantes c et d.
Ces questions préliminaires vont permettre de construire un diagramme simplifié
représentant les variations de log p(SOZ) en fonction de log p(Oz), àla
température de 950 K, pour
différents équilibres entre espèces solides (oxydes, sulfures, sulfate) du
cobalt ; ce diagramme
pourrait être appelé diagramme de prédominance ou de stabilité ; il est
comparable au diagramme
potentiel--pH relatif à la corrosion d'un métal.
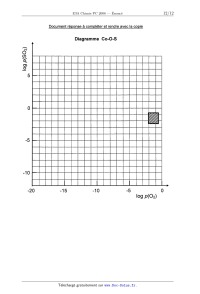
Ce diagramme doit être réalisé sur le document--réponse fourni avec le sujet,
et doit être
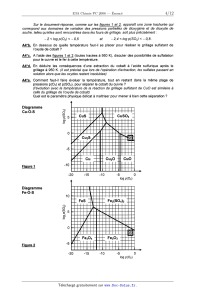
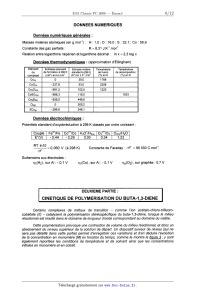
rendu avec la copie. Pour faciliter sa construction, sont fournis (figures 1 et
2) les diagrammes
similaires établis, également à 950 K, pour les systèmes Cu--O--S et Fe--O--S.
La frontière entre les domaines Co(s) et CoO(s) est une droite notée C,
d'équation :
log p(02)éq : --- 17,9 . La droite notée D, d'équation : log p(O, )éq == --- 2,
9 sépare les domaines des
deux oxydes CoO(S, et Co304(5).
A3*a. Tracer ces droites sur le diagramme. Retrouver la valeur de la frontière
log p(Q.,_)éO| : ---- 2,9
pour la droite D à partir de l'équation stoechiométrique d'oxydation de l'oxyde
de cobalt.
A3*b. Déterminer les pressions partielles, sous la forme log p(SOZ)Q et log
p(Oz)g, pour le point
d'intersection Q des droites A et B, puis tracer ces droites sur le diagramme.
La frontière entre le sulfure C0988(5) et le sulfate CoSO4(5) est une droite
notée E,
d'équation : log p(O2)éq ;; --- 12,7.
Les pentes des droites--frontières entre les autres espèces peuvent aisément
être
déterminées et valent respectivement :
frontière : Co(s) / C0988(S) droite F, de pente 1,
frontière : COQSB(S) / C082(S) droite G, de pente 1, passant parle point P de
coordonnées
log p(O,)P ;; --- 12,7 et log p(802)P : 4,0,
frontière 00304(s) / CoSO4(5) droite H, de pente --- 1/3.
A3*c. Ecrire l'équation-bilan entre 00845) et CoSO4(S) , puis calculer la pente
de la frontière
CoSz / CoSO4(S) (droite J).
A3*d. En opérant par continuité, terminer le tracé des différentes frontières.
Placer dans chaque
domaine l'espèce stable correspondante.
Ce diagramme n'est valable qu'à la température de 950 K et pourra donc évoluer
si la
température augmente. Sans pour autant retracer le diagramme, l'étude portera
plus
particulièrement sur l'évolution de la droite 8 séparant l'oxyde de cobalt du
sulfate de cobalt, pour
quelques températures. Des calculs analogues à ceux réalisés en A2*b et A2*c
fournissent :
température T = 900 K équation de B : log p(802)éq : ---- 5,6 ---- 0,5 log
p(02)éq,
température T = 1050 K équation de B : log p(802)éq : ----- 2,7 ---- 0,5 log
p(02)éq,
température T = 1100 K équation de B : log p(802)éq : ---- 1,9 --- 0,5 log
p(02)éq .
A4*a. Représenter sur le document-réponse (sous forme de traits discontinus)
les nouveaux
tracés de la droite B pour les trois températures mentionnées.
Tournez la page S.V.P.
Sur le document--réponse, comme sur les figures 1 et 2, apparaît une zone
hachurée qui
correspond aux domaines de variation des pressions partielles de dioxygène et
de dioxyde de
soufre, telles qu'elles sont rencontrées dans les fours de grillage, soit plus
précisément :
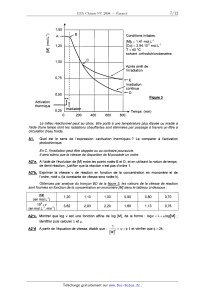
--2 Conditions initiales:
"â [M]O : 1,41 mon;1
v 1,25 [Co] = 2,94.1o*" mo|.L'1
E' T = 40 °C
"'" solvant :orthodichlorobenzène
1,00
Après arrêt de
l'irradiation
0,75 __ E
Irradiation
confinue
4-- D
Figure 3
Activation
thermique
Temps (min)
Le milieu réactionnel peut au choix, être porté à une température plus élevée
ou irradié à
l'aide d'une lampe dont les radiations chauffantes sont éliminées par passage à
travers un filtre à
circulation d'eau froide.
A1; Quel est le sens de l'expression «activation thermique» ? La comparer à
l'activation
photochimique.
En C, l'irradiation peut être stoppée ou au contraire poursuivie.
Il sera admis que la vitesse de disparition de M possède un ordre.
A2*a. A l'aide de l'évolution de [M] entre les points notés B et D, et en
utilisant la notion de temps
de demi--réaction, justifier que la réaction n'est pas d'ordre 1.
A2*b. Exprimer la vitesse v de réaction en fonction de la concentration en
monomère et de
l'ordre, noté oc (la constante de vitesse sera notée k).
Obtenues par analyse du tronçon BD de la figure 3, les valeurs de la vitesse de
réaction
sont fournies en fonction dela concentration en monomère [M] dans le tableau
ci--dessous :
III.--___"
en mol. L
3
en mol. L min -
A2*c. Montrer que log v est une fonction affine de log [M], de la forme: logv
== À+ulog[M] ;
identifier puis calculer 7\. et u.
A2*d A partir de l'équation de vitesse, établir que : = \V + cb t et vérifier
que : 2k.
[]2
Tournez la page S.V.P.
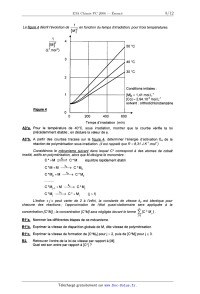
La figure 4 décrit l'évolution de [ 1]2 en fonction du temps d'irradiation,
pour trois températures.
M
1
2
[N'] 50 0c
(|.2 mol ")
Conditions initiales :
[M]O = 1,41 moii:1
[Co] : 2,94.10'2 mo...."1
solvant : orthodichlorobenzéne
Figure 4
Temps d'irradiation (min)
A3*a. Pour la température de 40°C, sous irradiation, montrer que la courbe
vérifie la loi
précédemment établie ; en déduire la valeur de d).
A3*b. A partir des courbes tracées sur la figure 4, déterminer l'énergie
d'activation Ea de la
réaction de polymérisation sous irradiation. (il est rappelé que R = 8,31
J.K'.mol')
Considérons le mécanisme suivant dans lequel C* correspond à des atomes de
cobalt
irradié, actifs en polymérisation, alors que M désigne le monomère :
C*+M a C*M équilibre rapidement établi
C*M+M ----'î°---> C*M2
C*M2 +M ----k--L--> C*M3
C*M --l'--t--> C*+M (j>1)
L'indice «j » peut varier de 2 à l'infini, la constante de vitesse kp est
identique pour
chacune des réactions ; l'approximation de l'état quasi--stationnaire sera
appliquée à la
concentration [C*MJ ; la concentration [C*M] sera négligée devant le terme 2 [C
* M j ] .
j=2
B1*a. Nommer les différentes étapes de ce mécanisme.
B1*b. Exprimer la vitesse de disparition globale de M, dite vitesse de
polymérisation.
B1*c. Exprimer la vitesse de formation de [C*MZ] pourj : 2, puis de [C*M,-]
pourj z 3.
_g_._ Retrouver l'ordre de la loi de vitesse par rapport à [M].
Quel est son ordre par rapport à [C*] ?
TROISIEME PARTIE :
SYNTHESE DE LA CORTISONE
lntéressons nous a quelques étapes dela synthèse dela cortisone :
cortisone
A I Synthèse historique
Une synthèse historique dela con'isone est celle de Woodward qui a fait réagir
le buta-1,3--
diène sur le composé [A].
A1. Quel est le nom de cette réaction '? Montrer qu'elle peut conduire à deux
isomères de
constitution.
Les orbitales moléculaires haute occupée (HO) et basse vacante (BV) de chaque
molécule
ont respectivement pour énergie :
A2*a. Justifier que l'interaction entre la BV de [A] et la HO du
bute-1,3--diène est la plus
favorable.
Les coefficients relatifs aux orbitales atomiques centrées sur les atomes de
carbone
(référencés 1 ' à 4') du buta--1,3--diène sont rassemblés dans le tableau
ci--dessous :
A2*b. Représenter les orbitales frontières du bute--1,3-diène.
Les coefficients relatifs aux orbitales atomiques centrées sur les atomes de
carbone
(référencés 1 à 4) du composé [A] sont, de même :
A2*c. Quel est l'isomère de constitution majoritaire [B], sachant que le
produit majoritairement
formé est obtenu en reliant les atomes présentant les coefficients les plus
forts (en valeur
absolue) pour les orbitales frontières concernées ?
Tournez la page S.V.P.
10
A3*a. Cette réaction est stéréosélective; représenter [B1] l'un des
stéréoisomères obtenus en
complétant le schéma ci--dessous ; préciser l'orientation de la liaison du C...
en la justifiant.
0 ?
° [Bi]
A3*b. Quelles sont les configurations de ses carbones asymétriques ?
A3*c. Quel est son hydrogène le plus mobile (justifier la réponse) ?
L'action d'une solution d'hydroxyde de sodium sur [Bd dans un mélange
eau--dioxane
conduit à un mélange de deux diastéréoisoméres; justifier la formation de
l'autre
diastéréoisomére [BH] à partir de [B1]. Représenter [BH].
A4. Déterminer les composés [C] et [D] obtenus par l'enchaînement réactionnel
ci--dessous :
1) 0s0 HIO
Quel type de réaction permettrait d'obtenir un cycle à 5 carbones à partir de
[D] ?
B I Synthèse plus récente
Le point de départ d'une autre synthèse de la cortisone est l'acide
désoxycholique [E] :
Raccourcissement de la chaîne latérale
[E] est traité par un oxydant doux (Cr03, pyridine par exemple) ; après
extraction et
purification, [F] est isolé. Il est transformé en [G] qui subit l'enchaînement
suivant de réactions :
PCI c H M Br en excès NHK, Cl" A
[G]--er--i--î-fi--ÎW--s m -------->lJ1------------>m (C40H5204)
dans l'ethoxyethane
B1. Représenter la formule topologique de [F].
BZ*a. Quel réactif permet de passer de [F] à [G] ? Cette réaction
nécessite-t--elle un catalyseur ?
BZ*b. Ecrire un mécanisme réactionnel illustrant la formation de [G] à partir
de [F].
11
Pour la suite, [G] peut être représenté parla représentation simplifiée
ci--dessous :
R
R! '
[G]
HO \O
B3*a. Détailler le mécanisme réactionnel illustrant l'obtention de [J] à partir
de [H] ; justifier le
choix de NH4+ en tant qu'acide faible.
B3*b. Représenter [K] .
[K] réagit avec du N--bromosuccinimide qui permet de fixer un atome de brome
sur le
carbone en a d'une double liaison, selon le schéma ci--dessous :
Br
W
R-CH=CH-CH-CH3
R-CH=CH-CHZ--CH3 ----------------------------------> |
Br
B4*a. Représenter le produit [L] obtenu.
Br OH
\ R
R . _ O R
R' \/CÔH5 R. R'
[M] [N]
CSHS
OH
o
Ü
[0]
B4*b. Décrire un enchaînement permettant de passer de [L] à [M].
B4*c. A quelles molécules conduit une ozonolyse de [M], suivie d'une hydrolyse
en milieu
réducteur?
B4*d. Comment obtenir [N] à partir de l'une d'entre elles ?
Par formation de cyanhydrine, déshydratation et oxydation, la chaîne latérale «
de la
cofiisone » peut être édifiée afin d'obtenir [ 0].
fig Proposer un enchaînement de réactions permettant d'obtenir [P] à partir de
[O].
FIN DE L'ENONCE
DOC REPONSE 1 PAGE
23/01/08
11:48
Page 1