Centrale Chimie PC 2016
| Thème de l'épreuve | Chimie verte |
| Principaux outils utilisés | diagrammes E-pH, courbes courant-potentiel, oxydoréduction, cinétique chimique, chimie organique, orbitales moléculaires |
| Mots clefs | biopile enzymatique, glucose oxydase, économie d'atomes, facteur environemental, flavonoïdes, Michaelis-Menten |
Corrigé
: 👈 gratuite pour tous les corrigés si tu crées un compte👈 l'accès aux indications de tous les corrigés ne coûte que 5 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)














Rapport du jury
(télécharger le PDF)


Énoncé obtenu par reconnaissance optique des caractères
C h i m ie ©
F|
PC c
4 heures Calculatrices autorisées N
Chimie verte
Les engagements pris lors de la COP 21 par tous les pays de réduire leurs
émissions de gaz a effet de serre invitent
tous les secteurs de la recherche, du développement et de la production à
débuter ou poursuivre des réflexions
pour limiter la consommation d'énergie, économiser les ressources naturelles,
mieux contrôler la pollution et
favoriser le recyclage. Le secteur de la chimie a initié depuis plusieurs
décennies de nombreuses études et
évolutions pour diminuer l'empreinte environnementale des procédés ; cela a
conduit en particulier au concept
de « chimie verte », ensemble de principes et techniques visant à réduire ou
éliminer la formation de substances
dangereuses ou toxiques dans la conception, la production et l'utilisation des
produits chimiques. Par ailleurs,
la substitution de produits issus de la pétrochimie est encouragée au profit
d'espèces renouvelables provenant
de la biomasse.
Ce sujet porte sur l'étude de dispositifs et de synthèses en lien avec cette
problématique. Il est composé de deux
parties distinctes ; la première s'intéresse au fonctionnement de biopiles
enzymatiques générant de l'électricité à
partir de glucose et la seconde propose une étude des propriétés
anti--oxydantes des fiavonoi'des, puis une analyse
de recherches effectuées pour proposer une voie de synthèse éco--compatible de
fiavonoi'des hydrosolubles.
Les données utiles figurent en fin d'énoncé. Cet énoncé est accompagné d'un
document réponse a rendre avec
la copie.
I Autour des biopiles enzymatiques
Les piles à combustibles figurent parmi les technologies vertes prometteuses
pour la production ponctuelle
d'énergie « renouvelable ». Les biopiles enzymatiques mettent en jeu des
enzymes pour catalyser la réaction de
fonctionnement de la pile ; elles ont comme enjeux une réduction de la taille
et des coûts et un fonctionnement
dans des conditions douces, potentiellement physiologiques. Cette technologie
ne rivalise pas encore, en termes
de puissance et de durée de vie, avec les piles à combustibles classiques
utilisant le dihydrogène ou le méthanol
comme carburant. Cependant elle peut être envisagée pour des applications
nécessitant des piles miniatures et
peu de puissance (biocapteurs, implants médicaux, ). Les biopiles enzymatiques
étudiées utilisent du glucose
comme carburant. Le glucose est une source d'énergie peu onéreuse et idéalement
renouvelable car il est produit
par photosynthèse dans les plantes qui convertissent l'énergie solaire en
énergie chimique. Durant ce processus,
en présence de lumière, le dioxyde de carbone et l'eau sont transformés en
glucose et dioxygène au cours d'une
succession complexe de réactions chimiques.
I.A -- Cinétique de la réaction d'oæydation du glucose catalysée par la glucose
omydase
Les enzymes sont des catalyseurs biologiques qui comportent un site actif sur
lequel se fixe le substrat (réactif)
et s'opère la transformation en produit. La structure du site actif est
spécifique de la réaction qu'il catalyse et
elle retrouve sa forme initiale après libération du (ou des) produits formés.
L'enzyme glucose oxydase catalyse
l'oxydation par le dioxygène du D--glucose en acide D--gluconique, appelés par
la suite glucose et acide gluconique.
HO \H H \OH O HO \H
H \OH 0
| l HO
HO
H OH
H ÇOH H ÇOH H 'OH H ÇOH
D--glucose acide D--gluconique
Figure 1 Structures spatiales des formes linéaires du D--glucose et de l'acide
D--gluconique
I.A.1) Rôle d'un catalyseur
Le profil réactionnel d'une réaction est reproduit figure A du document réponse.
a ) Quelle(s) information(s) fournit ce profil réactionnel sur la réaction '?
b) Tracer, sur cette figure, l'allure d'un profil réactionnel de cette même
réaction catalysée.
c) Expliciter l'influence de la catalyse sur la thermodynamique et la cinétique
d'une réaction. La catalyse
enzymatique se distingue--t--ellc des autres types de catalyse '?
2016--03--02 19:31:31 Page 1/14 GQ BY--NC-SA
I.A.2) Modélisation de l'oxydation du glucose par le modèle de Michaelis--Menten
À 20 °C et en solution à pH tamponné égal à 7, on détermine expérimentalement,
pour différentes concentrations
initiales en glucose, la vitesse initiale vo de la réaction d'oxydation du
glucose par le dioxygène catalysée par
la glucose oxydase, la glucose oxydase est introduite en proportions
catalytiques par rapport au glucose. La
courbe tracée figure 2 représente l'évolution de la vitesse initiale de cette
réaction. La concentration en dioxygëne
dissous reste constante.
4,0 4
3,5 -
Î 3'0 _ vo [glucose]0
.Ë 2 5 * (pmol'L"l'min"l) (mmol-Lfl)
T' 0,42 2,0
% 2,0 " 0,97 5,0
à 175 , 1,71 10
:O 1 0 2,49 20
' 3,53 50
0,5 - 3,72 100
070 | ] | | | | ]
0 20 40 60 80 100 120
[glucose] 0 (mmolL--1)
Figure 2 Évolution de la vitesse initiale d'oxydation du glucose
Le modèle choisi pour rendre compte de la cinétique de la réaction d'oxydation
du glucose par le dioxygène,
catalysée par la glucose oxydase, est celui de Michaelis--Menten qui est un des
modèles de mécanisme réactionnel
les plus couramment utilisés pour les réactions catalysées par une enzyme. Ce
mécanisme s'écrit :
k
a k
E+Sv--*--ES ES-%P
,.
où E désigne l'enzyme (glucose oxydase), S le substrat (glucose), ES le
complexe enzyme--substrat formé et P
le produit (acide gluconique) et où k... k; et kb sont les constantes
cinétiques des différentes étapes.
Le volume réactionnel est supposé constant au cours de la transformation du
glucose en acide gluconique. On
note ]X ] la concentration de l'espèce X dans le milieu réactionnel a un
instant t donné et ]X]0 cette concentration
a l'instant initial. Le schéma de la figure 3 représente l'évolution temporelle
des concentrations du substrat (S),
du produit (P), de l'enzyme (E) et du complexe enzyme--substrat formé (ES) au
cours de la réaction pour des
valeurs relatives de constantes de vitesse ka, kg et kb.
fSl0 fPl
%
%
ES {El
0 temps
Figure 3 Evolution de la concentration des espèces mises en oeuvre dans le
modèle de Michaelis--Menten
Le modèle de Michaelis--Menten présente trois caractéristiques principales au
niveau cinétique :
-- pour une concentration initiale donnée de substrat, notée ]S]O, la vitesse
initiale de formation du produit est
proportionnelle à la concentration totale de l'enzyme, ]E]0 ;
-- pour une concentration totale de l'enzyme ]E]() et une faible concentration
initiale de substrat ]S]... la vitesse
initiale de formation du produit est proportionnelle à ]S]0 ;
-- pour une concentration totale de l'enzyme ]E]0 et une forte concentration
initiale de substrat ]S]O, la vitesse
initiale de formation du produit devient indépendante de lS]0 et atteint une
valeur maximale 0
max '
2016--03--02 19:31:31 Page 2/14 ("9--
À propos des résultats expérimentaux
a ) Écrire l'équation de la réaction d'oxydation du glucose par le dioxygène
catalysée par la glucose oxydase.
b) Comment obtenir expérimentalement la valeur de la vitesse initiale '? La
réponse pourra s'appuyer sur un
schéma.
0) Analyser l'allure de la courbe. Comment interpréter l'asymptote horizontale
pour des valeurs élevées de la
concentration initiale en glucose ?
À propos du modèle
d) Préciser pour quelle(s) espèce(s) chimiques(s) l'approximation des états
quasi--stationnaires est applicable et
sur quel intervalle de temps. Justifier.
@) Ecrire la loi de conservation de l'enzyme à l'instant t, {E]O représentant
la concentration initiale en enzyme.
f ) Sachant que l'enzyme est introduite en proportions catalytiques par rapport
au glucose, que peut--on dire de
la concentration du glucose libre par rapport a la concentration totale du
glucose ?
Umax iSi
_. Préciser
K... + fil
9) Montrer que l'expression de la vitesse 0 dans le cadre de ce modèle peut
s'écrire : v :
7 ' \
l express1on de vmaX et de K....
Confrontation des résultats expérimentaux et du modèle
h) Quelle(s) caractéristique(s) cinétique(s) du modèle de Michaelis--Menten
rend(ent) compte des résultats ex--
périmentaux obtenus ?
i) Proposer une estimation de la valeur expérimentale de um... pour la réaction
d'oxydation du glucose catalysée
par la glucose oxydase.
j ) À partir des résultats expérimentaux (figure 2), on réalise le tracé de
Lineweaver--Burk, courbe représentative
1 1
de -- en fonction de _ (figure 4). La courbe est ajustée par une fonction de
référence affine, le carré
"0 {glucose]0
du coefficient de corrélation linéaire associé 1" est 0,9988. En déduire une
seconde estimation de la valeur de
vmax. Commenter ce résultat et discuter de la donnée du carré du coefficient de
corrélation linéaire 73 pour la
validation du modèle de Michaelis--Menten pour cette réaction.
2
2,5
A 2
l
% 1 5 y : 4,3552æ + 0,1863
? 7 r2 : 0,9988
"ê
@, 1
5
\
H 0,5
0
0 0,1 0,2 0,3 0,4 0,5 0,6
1/{glucose]0 (meol"')
Figure 4 Tracé de Lineweaver--Burk pour la réaction d'oxydation du glucose
I.B * Biopile glucose/diomygène : un dispositif pour convertir l'énergie
solaire en énergie élec-
trique
La première biopile enzymatique étudiée est la biopile glucose/dioxygène
schématisée figure 5.
Glucose B
BOD
A dioxygène
Figure 5 Schéma de la biopile à glucose /dioxygène
2016--03--02 19:31:31 Page 3/14 GQ BY--NC-SA
À une électrode se trouve, l'enzyme glucose oxydase (GOoe) qui catalyse
l'oxydation du glucose. À l'autre
électrode la bilirubine oxydase (BOB) catalyse la réduction du dioxygène. Ces
enzymes ne sont pas en solution,
mais « immobilisées » aux électrodes grâce à des espèces appelées médiateurs,
notés M et M ', auxquelles elles
sont liées. Ceci permet de les stabiliser et de pouvoir les séparer des
produits de la réaction pour les réutiliser.
I.B.1) Fonctionnement général de la biopile et tension à vide
a ) Le schéma de la biopile étudiée est reproduit sur la figure B du document
réponse. Compléter cette figure
en orientant les flèches des déplacements des électrons entre enzymes et
électrodes via les espaces médiatrices
M et M '. Préciser quelle électrode est l'anode et laquelle est la cathode.
b) En déduire le sens du passage du courant électrique dans la résistance et la
polarisation de la biopile.
0) Ecrire les équations des réactions intervenant aux électrodes lorsque la
biopile fonctionne.
d) Sachant que la valeur de l'enthalpie libre standard, à 298 K, de la réaction
de fonctionnement de la biopile
pour une mole de dioxygène est --2,510 >< 105 J -mol"l, déterminer la tension à vide standard de la pile à cette température. Prévoir l'effet d'une augmentation de la température sur celle--ci, en supposant la réaction sous contrôle enthalpique (contribution négligeable du terme entropique dans l'enthalpie libre standard de réaction). I.B.2) Applications Une biopile glucose / dioxygène a été réalisée en implantant des électrodes dans un grain de raisin. Ces électrodes sont constituées de fibres de carbone de 7 pm de diamètre et 2 cm de long sur lesquelles sont immobilisées des enzymes, GOOE sur l'une et BOD sur l'autre. Sur la photographie (figure 6), les électrodes sont représentées par deux traits, car trop fines pour être visibles à l'oeil nu. Figure 6 Biopile glucose/dioxygène dans un grain de raisin La pile ainsi constituée présente initialement une tension à vide de 0,8V et délivre une densité de puissance maximale de 240 uW-cm"2. Cette puissance a diminué de 22% après 24 h de fonctionnement en continu. a ) lnterpréter ces observations expérimentales. En implantant ces deux électrodes dans un cactus du genre Echinocereus placé à proximité d'une lampe, des chercheurs ont pu montrer que les courants dans les deux électrodes augmentaient ou diminuaient selon que la lampe était allumée ou éteinte (figure 7) 1,5 Extinction 1 W 0'5 / Électrode de carbone avec GOoe Ë 0 % _075 Allumage (I) 5 : --1 \ --1,5 _2 / Électrode de carbone avec BOD 2 5 Extinction ' 0 1000 2000 3000 4000 5000 6000 temps (s) Figure 7 Dispositif expérimental et évolution des courants dans chacune des électrodes de carbone mesurés avec une contre électrode de platine Lors du fonctionnement de cette biopile glucose / dioxygène, la puissance maximale a été mesurée sous illumina-- tion à une valeur de 9 pW--cm_2, supérieure de 70% à celle obtenue dans l'obscurité. b) Proposer une interprétation a ces observations expérimentales. 0) Quelle donnée quantitative pourrait--on obtenir sur le processus de photosynthèse a partir de cette expé-- rience '? 2016--03--02 19:31:31 Page 4/14 Î@_ I.C -- Bi0pile glucose/urée à gradient de pH : un dispositif à vocation médicale Le principe de fonctionnement de la biopile glucose / urée repose sur l'apparition d'un gradient de pH entre les deux compartiments de la pile, gradient qui va engendrer une différence de potentiel entre les deux électrodes de la biopile du fait de la présence d'un couple oxydant / réducteur dont le potentiel dépend de la valeur du pH. Dans l'étude qui suit, ce couple est la quinhydrone, mélange équimolaire solide de 1,4--benz0quinone (notée Q) et d' hydroquin0ne (notée QH2) ,(figure 8) 1,4--benzoquinone (Q) O:Ç>:O hydroquin0ne (QH2) HO @ OH
Figure 8 Formules topologiques des composés Q et QH2
Deux réactions permettent de générer le gradient de pH ; l'oxydation du glucose
en acide gluconique catalysée
par la glucose oxydase (GOOE) dans l'un des deux compartiments et la
dégradation de l'urée (H2NCONH2) en
dioxyde de carbone et en ammoniac catalysée par l'uréase dans l'autre.
L'équation de la réaction de dégradation
de l'urée s'écrit :
uréase
H2NCONH2 + H20 : 2 NH3 + 002
Le schéma de la biopile glucose / urée a gradient de pH est donné sur la figure
9.
électrode de électrode de
| |
\ llllllllllllllllllllllll | à | lllllllllllllllllllllll . /
carbone (1) \ : ?â: / carbone (2)
5 : à : 5
: : | %0l : '
: Quinhydr0ne E '?) : : Quinhydr0ne ;
/'Ë en solution 5 : b0 : 5 en solution \
membrane / Il uuuuuuuuuuuuuuuuuuuuuuuu |% | Il uuuuuuuuuuuuuuuuuuuuuuuu \
membrane
GO?" : $--4 : "réaSC Ammoniac
Glucose ----> Acide gluconique . :: . Urée --> .
.E . D10xyde de carbone
Figure 9 Schéma d'une biopile glucose / urée a gradient de pH (le mur de gel
agar--agar sert de jonction
électrolytique entre les deux compartiments de la biopile)
I.C.1) Gradient de pH et évolution des potentiels d'électr0de
a) Prédire les évolutions temporelles du pH dans chacun des compartiments
lorsque la pile ne débite pas.
Justifier.
b) Écrire la demi--équation électronique du couple Q/QH2 et l'expression du
potentiel associé à ce couple.
0) En déduire le pôle positif et le pôle négatif de la biopile et écrire les
réactions aux électrodes lorsque la pile
débite.
Une pile modèle est constituée d'une électrode de carbone plongeant dans une
solution de quinhydrone de pH
variant de 0 à 14 (électrode de travail) et d'une électrode de carbone
plongeant dans une solution de quinhydrone
de pH constant égal à 7 (électrode de référence). La figure 10 représente
l'évolution théorique, a 25 °C, de la
tension à vide entre les deux électrodes de cette pile modèle, en fonction du
pH de la solution de quinhydrone
dans laquelle trempe l'électrode de travail.
d) lnterpréter le plus précisément possible l'allure de cette courbe et
commenter, en les justifiant, les places
relatives des différentes espèces.
AE (V) .
0,4 _
0,2 _
_072 _
_0'4 "
Figure 10 Tension à vide aux bornes de la pile modèle
2016--03--02 19:31:31 Page 5/14 GQ BY--NC-SA
e ) Établir, dans le domaine de pH 0--10, la relation affine théorique entre la
tension à vide AE de la pile
modèle et la différence de pH entre les deux compartiments de la pile : |ApH| :
pH,,prc, où a et c désignent
respectivement l'anode et la cathode de la pile.
f ) On cherche à déterminer le potentiel standard d'oxydoréduction du couple de
Q/QH2. Une lecture graphique
du diagramme de la figure 10 permet--elle d'y avoir accès '?
g) Proposer un protocole expérimental détaillé et l'exploitation des résultats
permettant de déterminer expéri--
mentalement ce potentiel standard.
Le temps nécessaire à la rédaction de la réponse à cette question est pris en
compte dans le barème.
I.C.2) Fonctionnement de la biopile glucose/urêe et tension à vide
L'étude du fonctionnement de la biopile glucose/urée a gradient de pH commence
par l'étude de son temps de
charge. Pour cela, on mesure l'évolution et la stabilisation du potentiel de
chacune des électrodes carbone /quin--
hydrone (mélange équimolaire de Q et QH2 a 3,2 >< 1(T3 mol'L*1) de la biopile : -- électrode (1) trempant dans une solution aqueuse de glucose a 5,0 >< 10'3 mol-L'1 en présence de 22,8 mg de GOLD ; -- électrode (2) trempant dans une solution aqueuse d'urée a 3,5 >< 10'3 mol--L"1 en présence de 57,3 mg d'uréase. Afin de valider les systèmes rédox mis en jeu dans ces deux électrodes, une fois les valeurs extrémales de potentiel et de pH atteintes, on étudie le potentiel de l'électrode carbone/quinhydr0ne en l'absence d'enzyme, en la trempant dans des solutions dont le pH est fixé à ces valeurs extrémales, par ajout d'acide ou de base : -- électrode (3) trempant dans une solution d'acide chlorhydrique à pH : 3,15 ; -- électrode (4) trempant dans une solution de soude à pH : 7,60. La figure 11 présente l'évolution temporelle des potentiels de ces 4 électrodes par rapport a une électrode au calomel saturé (ECS) 0,25 Temps (h) Figure 11 Évolution temporelle du potentiel d'électrode à courant nul dans quatre solutions (1) Attribuer chacune des courbes i, ii, iii et iv a une des électrodes (l), (2), (3) et (4) et expliciter leur allure. b) Estimer le temps de charge de la biopile glucose /urée, ainsi que la tension à vide atteinte lorsque la biopile est chargée. Dans un deuxième temps, on trace, pour chacune des deux électrodes ( l) et (2), les courbes courant--potentiel ; les électrodes ayant atteint leur potentiel extremum à courant nul, on mesure l'évolution du courant traversant l'électrode en imposant des surtensions à l'électrode par rapport a une électrode au calomel saturée. On obtient les deux courbes représentées sur la figure 12. 1 '] (mA) 0,75 0,5 0,25 , E (V) / ses 0,25 --0,25 --0,5 --0,75 --1 Figure 12 Courbes courant--potentiel des électrodes (l) et (2) par rapport à l'ECS 2016--03--02 19:31:31 Page 6/14 (c_ c) Attribuer les courbes aux électrodes (1) et (2) et annoter la figure C du document réponse en indiquant la courbe relative à l'oxydation et celle relative à la réduction des espèces Q et QH2. d) Peut--on retrouver la valeur de la tension à vide de la biopile modèle étudiée à partir de la figure 12 ? Justifier. @) Prévoir la valeur de la tension aux bornes d'une biopile glucose/urée qui débiterait un courant de 250 11A et la valeur de la puissance de la pile. On réalise une biopile glucose/urée telle que celle représentée figure 9 avec les électrodes (1) et (2) et un mur d'agar--agar de 5 mm. Après un temps de charge de 12 heures, les valeurs de pH atteintes dans chaque compartiment sont de 3,9 et 6,6 et la tension à vide vaut 0,133 V. Par ailleurs, la puissance maximale est de 4,9 pW à 0,073 V. f ) Confronter les caractéristiques de la biopile réelle à celles de la pile modèle et des électrodes qui la constituent. II Autour des flav0n0ïdes Les fiavonoÏdes (de flavu5, jaune en latin) sont une classe de composés polyphénoliques largement répandue dans le règne végétal. Ils sont en particulier responsables des couleurs variées des fleurs et des fruits. Leur structure de base, issue d'une origine biosynthétique commune, consiste en deux cycles aromatiques en C6 (nommés A et B) reliés par un chainon a trois atomes de carbone souvent engagé dans un lien éther avec un des cycles aromatiques (formation d'un hétérocycle nommé C). Le groupe des flavonoi'des est extrêmement diversifié : plusieurs milliers de composés ont été recensés. La catéchine est un exemple de fiavonoi'des, connue sous le nom de catéchol. Initialement découverte dans les fruits de l'accacia à cachou (Accacia catechu), on en trouve en grande quantité dans les thés, thés verts notamment, les fèves de cacao, les pommes, les raisins et le vin rouge. La catéchine et ses nombreux isomères, comme la plupart des fiavonoïdes, sont de puissants anti--oxydants qui aident à prévenir les maladies inflammatoires et coronariennes. Structure de base des fiavonoÏdes Structure de la catéchine Figure 13 II.A -- Propriétés anti-oæydantes des fiavonoïdes Une composante de l'activité des fiavonoi'des est leur aptitude à réagir, en tant que réducteur, avec les radicaux libres, oxydants puissants formés dans l'organisme par la dégradation de molécules telles que les protéines, l'ADN ou les phospholipides constituant les membranes lipidiques. L'activité anti--oxydante réductrice des fiavonoÏdes (notés OH) peut être étudiée en utilisant le test au
2,2--diphenyl--1--picrylhydrazyl (DPPH) au cours duquel ce
radical, relativement stable, est réduit en DPPH2 suivant la réaction
d'équation :
DPPH + OEOH --> DPPH2 + O°
On étudie, par suivi spectrophotométrique, la cinétique de cette réaction entre
la catéchine et le DPPH. À cet
efiYet, on réalise, dans un premier temps, les spectres des formes oxydée et
réduite du DPPH et de la catéchine
(figure 14).
1 -- DPPH -- Catéchine
8 0,8 ÏHDPPH2 8 0915
% 53
EUR 0,6 EUR 0,010
% 0 4 %
.D 7 .D
< < 0,005 0,2 _ 0 0,000 >
300 350 400 450 500 550 600 650 250 270 290 310 330 350
Longueur d'onde (nm) Longueur d'onde (nm)
Figure 14 Spectres d'absorption
L'étude de l'absorbance a 520 nm d'une solution de concentrations initiales
{DPPH]0 : 1,0 >< 10Î4 mol-L*1 et lcatéchine]0 : 1,1 >< 10Î2 molLÿ1 fournit les graphes de la figure 15. 2016--03--02 19:31:31 Page 7/14 ("9-- 12 (a) Absorbance à 520 nm 0,8 0,6 0,4 0,2 0 5 10 15 20 25 30 t (S) 0 0,5 1 1,5 2 É (8) Figure 15 (a) évolution temporelle de l'absorbance a 520 nm (b) transformée de Guggenheim : T est l'intervalle de temps constant entre deux mesures d'absorbanoe II.A.1) Analyser les conditions expérimentales choisies. Conclure. II.A.2) Dans l'hypothèse où la réaction admet un ordre 1 par rapport à chacun des réactifs, écrire l'expression de la loi de vitesse de la réaction dans le cadre des conditions expérimentales choisies. II.A.3) Proposer une valeur pour la constante de vitesse de la réaction dans les conditions expérimentales choisies et dans le cadre de l'hypothèse proposée. Conclure. Cette question n'est pas guidée et demande de l'initiative de la part du candidat. Même si elles n'ont pas abouti, les pistes de recherche doivent être consignées, si elles sont pertinentes, elles seront valorisées. Le barème tient compte du temps nécessaire pour eæplorer ces pistes et élaborer un raisonnement. II.B * Synthèse de fiavonoi'des glycosylés dans le cadre de la chimie verte L'étude qui suit porte sur les travaux conduits par Freddy Pessel dans la cadre de sa thèse de doctorat « Synthèse écocompatible de fiavonoides fonctionnalisês par le glucose comme anti--oxydants potentiels ». L'ajout d'un motif sucre (le glucose par exemple) accroit la solubilité du fiavon0ïde. Le schéma de rétrosynthèse de la figure 16 présente la stratégie retenue par F. Pessel. R2=HOUOH r 8110 _) Ban0
BnO 80% BnO 'O BnO /
OBn
OH
Et3SiH BF3. OE12, CH30N mCPBA. CHZCl2 DlBAL/BuLi, THF
Bn0 Composé A -->
76% (2 étapes) B"° 85% 92%
_îape 6 _tape 7
OH
C o . H so 0
BnO r 3 2 4 BnO Pd/C Hg,ACOH MeOH HO
E... 86% B"° 90% H0 OH
1 0
Figure 17 Synthèse du motif sucre 1 proposée par Howard et Withers
(1) Quelles est la nature des étapes 1 et 6 ? Proposer une équation pour la
réaction mise en jeu dans l'étape 6
en utilisant une écriture simplifiée pour les composés organiques.
b) Donner l'équation de la réaction de formation du composé organo--métallique
utilisé dans l'étape 2. Justifier
le choix du solvant diéthyléther. Quels sont les inconvénients et contraintes
de l'utilisation de ce type de réactif '?
Quel autre réactif, non mentionné sur le schéma de la synthèse, faut--il
utiliser pour finaliser l'étape 2 '? Justifier.
0) Quel est la formule du composé A produit dans l'é etape 4 ? Justifier
l'intérêt de l'utilisation de ce type de
composé comme intermédiaire de synthèse.
d ) Le DlBAL libère un ion hydrure. Proposer un mécanisme pour la réaction mise
en jeu entre le composé A
et le DlBAL dans l'étape 5.
@) Quel(s) inconvénient(s) présente la synthèse proposée par Howard et Withers
du point de vue de la « chimie
verte » '?
Synthèse alternative
En 2000, une synthèse verte « one--pot » dans l'eau du motif sucre 1 a été
proposée par l'équipe de Lubineau
avec comme réactifs le glucose, la pentane--2A--dione et l'hydr0génocarbonate
de sodium (figure 18).
2.4- -pentanedione (1 3 éq)
OH 0 N HCO 15 ) OH 0
a e
Hom À) Ho
HO OH .... H20 110°C HO
on
100%
1 0
Figure 18 Synthèse verte « one pot » du motif sucre : glucose --> 1
Le produit est initialement obtenu sous la forme d'un mélange de dérivés a-- et
fi--pyranoses (cycles a 6 atomes) et
furanoses (cycle à 5 atomes) qui, lors d'un chauffage prolongé, conduit
exclusivement au fi--pyranose (composé 1).
f ) Justifier la stabilité du composé 1 produit par rapport aux autres dérivés.
9) Calculer l'économie d'atomes (AE) pour cette synthèse et la comparer a celle
de la synthèse d'Howard et
Withers.
II.B.2) Optimisation de la réaction de bromation 1 --> 2
Pour optimiser la réaction de bromation, différentes conditions opératoires ont
été envisagées. Les résultats
de deux d'entre elles sont rassemblés dans le tableau 1. Dans le cas (a),
l'agent de bromation est le di--
brome Br2, dans le cas (b) c'est le tribromure de pyridinium déposé sur support
polymère (copolymère de
4--vinylpyridine/styrène) .
2016--03--02 19:31:31 Page 9/14 (cc BY--NC-SA
Agent de
Cas . T Durée Traitement Rendement Rapport 2 / 2' E
bromat10n
Br NaHSO3
(a) ,2 25 °C 2,5 h Na2CO3 61% Traces de 2' 17923
2,0 eq. .
Chromatographie
/ \Ê_ H BrÎ Na CO
(b) _ 3 25 °C 2 h 2 3 . 54% Traces de 29 1225,6
1 3 , Chromatographie
, eq.
Tableau 1 Conditions opératoires et résultats pour l'étape de bromation 1 % 2
Outre le composé 2 attendu, on obtient un composé secondaire 2' qui possède un
spectre de RMN 1H identique
a celui de 2, à l'exception du remplacement d'un singulet a 4,35 ppm, intégrant
pour deux protons, par un
singulet a 6,47 ppm, intégrant pour un proton.
a ) Après examen du schéma de rétrosynthëse de F. Pessel, expliquer le rôle de
cette étape de bromation.
b) lnterpréter les données de RMN 1H. Comment accéder au rapport entre les
quantités de matière de 2 et 2'
a partir du spectre de RMN 1H du brut réactionnel '?
c) Dans le cas (a), en fin de réaction et avant purification, un traitement à
l'aide d'une solution aqueuse
réductrice d'hydrogènosulfite de sodium (NaHSO;;) est réalisé, ce qui permet
une augmentation du rendement.
Proposer une explication.
d) Du point de vue de la sécurité et de la chimie verte, quel est l'intérêt du
tribromure de pyridinium supporté
par rapport au dibrome '?
II.B.3) Synthèse de l'az0ture d'acyle 2 --> 3
L'azoture d'acyle (composé 3) est obtenu par action de l'azoture de sodium sur
le dérivé bromé 2.
a) Donner un schéma de Lewis de l'ion azoture.
b) Le schéma de rétr0synthèse fait apparaitre un mécanisme de type SN2 pour
cette étape. Les conditions
favorisant ce mécanisme limite sont--elles réunies dans cette synthèse ?
II.B.4) Première étape de la synthèse du motif flavono'1'de : O--a1ky1ati0n
La synthèse de la 2'--hydroxy--4'--propargyloxyacétophênone (composé 4) (figure
19) est réalisée par O--alkylation
dans le polyéthylène glycol diméthyléther (figure 20) selon le protocole
expérimental décrit ci--dessous.
HO OH \\\/0 OH
0 4 0
Figure 19 Synthèse de la 2'--hydroxy--4'--propargyloxyacêtophënone 4 a partir
de paratoluènesulfonate de
pr0pargyle HC E C -- OTs avec OTs : OSO2 -- C6H4 -- CH3
æ°/\%V% ...o«ivi...
Figure 20 Formules du polyéthylène glycol (PEG) et du polyéthylène glycol
diméthyléther (PEG(OMe)2 )
Protocole expérimental : 10,6 g de 2',4'--dihydroxyacétophênone sont dissous
dans le polyéthylène glycol diméthy--
léther 500 (35 mL) et le mélange est chauffé à 60 °C. 11,5 g de carbonate de
potassium (K2C03) en poudre sont
lentement ajoutés et le mélange est agité durant 15 minutes. Le
parat0luènesulfonate de pr0pargyle (12,0 mL,
p : 1,215 g-mLÏ1 a 20 °C) est ajouté et le mélange est agité à 60°C durant deux
jours. Après refroidissement à
température ambiante, le mélange est dilué avec de l'eau (100 mL) et de l'acide
chlorhydrique à 37% (7 mL) est
ajouté. Le mélange est ensuite extrait au diéthyléther (120 mL puis 3 >< 30 mL). La phase organique recueillie est lavée avec une solution aqueuse de chlorure de sodium a 12% (50 mL) puis concentrée sous vide. Le produit brut est traité par deux recristallisations successives. On récupère enfin le produit solide purifié et séché (10,96 g). a) Le polyéthylène glycol diméthylether chélate l'ion potassium. Quel avantage cela présente--t--il dans la synthèse du composé 4 '? Compte tenu des conditions expérimentales, justifier de l'utilisation d'un éther de PEG plutôt que d'un PEG. b ) Quel intérêt présente le groupe paratoluène sulfonate dans cette réaction '? 0) Calculer le rendement de l'étape de O--alkylation. 2016--03--02 19:31:31 Page 10/14 (c_ II.B.5) Deuxième étape de la synthèse du motif flavono'1'de : réaction d'aldolisation 4 --> 5
a) En milieu basique, la déprotonation du groupe hydroxyle provoque
l'inactivation de la réactivité électrophile
de la fonction aldéhyde. Justifier ce résultat. Par quelle étape préliminaire
peut--on éviter cette réaction parasite ?
Une telle étape est--elle souhaitable dans le cadre de l'optimisation de
l'économie d'atomes '?
Pour éviter la réaction parasite précitée, la réaction est ici conduite en
présence d'un mélange catalytique de
pyrrolidine et d'acide acétique (milieu neutre), ce qui conduit a la formation
d'un mélange de la chalcone 5 en
équilibre avec la fiavonone 5' racémique (figure 21).
Figure 21 Équilibre chalcone = fiavonone : 5 = 5'
b ) Proposer un mécanisme pour la formation de la fiavonone a partir de la
chalcone et expliquer le caractère
racémique du mélange.
La dernière étape de la synthèse du motif fiavonoïde (obtention du cycle C) est
ensuite réalisée par une réaction
d'Algar--Flynn--Oyamada (APO) (figure 22), qui ne sera pas étudiée ici. On
obtient alors la série de composés 6.
NaOH
H;02 30%
8R1=R2=H
bR1=OH,RZ=H
cR,=OMe.R:=H
5 a--d dR1=OH,RQ=OH 6 a--d
Figure 22 Réaction d'Algar--Flynn--Oyamada 5, 5' --> 6
II.B.6) Synthèse des glycosy1flavono'fdes par chimie click
La réunion des synthons 3 et 6 fait appel a une réaction de cycloaddition
dipolaire [2 + 4] entre un alcyne et
un azoture d'acyle, qui s'apparente à la réaction de Diels--Alder (figure 23).
Ce type de couplage porte le nom
de « chimie click ».
OH OH
H HO
'ào Ho
H DH
3 a
0 0
Cu(l)
---> 11 a,c
PEG zoom--go
60°C
3 : R = H
c : R : OMe
Figure 23 Cycloaddition dipolaire ; étape 6 + 3 --> 11
On cherche, dans un premier temps, à étudier certaines caractéristiques de la
réaction de couplage par « chimie
click » sur l'exemple de réactifs modèles : le phénylacétylène (Ph -- C E CH)
et l'azoture de phényle (Ph -- N3).
Les résultats expérimentaux pour cette réaction sont présentés figure 24 ; les
pourcentages correspondent aux
rendements des produits par rapport au réactif en défaut, l'azoture de phényle
dans cette synthèse.
La figure 25 présente les orbitales frontalières des deux réactifs. Les
surfaces des cercles entourant les atomes
sur le diagramme sont a peu près proportionnelles au coefficient de l'orbitale
moléculaire sur l'atome. Dans le
cas de l'azoture de phényle, seul le squelette a est représenté.
0) Donner les formules des deux produits A et B, formés par cycloaddition {2 +
4] entre l'azoture de phényle et
le phénylacétylène. Proposer un mécanisme pour cette réaction.
2016--03--02 19:31:31 Page 11/14 (cc
toluène, reflux
Ph-N3 + Ph-CECH T A + B
42,5% 51,5%
Figure 24 Bilan et résultats expérimentaux pour la réaction de cycloaddition
1,3--dipolaire du
phénylacétyiène avec l'azoture de phényle
E(eV) Ph
Ph
N
_10 Ph®
Figure 25 Interactions entre orbitales frontières pour la réaction de
cycloaddition 1,3--dipolaire du
phénylacétylène (Ph -- CCH) avec l'azoture de phényle (Ph -- N3)
b) Interpréter la régiosélectivité observée pour cette réaction.
Pour améliorer la sélectivité de la réaction 3 + 6 --> 11, de nombreux auteurs
ont montré l'importance de
l'utilisation d'un catalyseur. En particulier Sharpless et coll. ont établi
l'activité catalytique de complexes du
cuivre (1) vis à vis des cycloadditions entre alcynes et azotures d'acyle. Ce
catalyseur a été utilisé par F. Pessel
dans sa synthèse et la réaction symbolisée par l'acronyme CuAAC dans son schéma
rétrosynthétique.
II.B.7) Bilan : schéma de synthèse global
La figure 26 donne le schéma global de la synthèse réalisée par F. Pessel dans
sa thèse et la figure 27 quelques
données numériques.
H
no OH °"
Hp [ 100% lPEG(OMeh 5000
\ R
H 0 \\/0 OH or--
... \©:{ 1
H0
" |
o o o
EtOH 54% R = H 184% R
R = OMe : 71% DH
m%gæ °"
PEG 2000 OH
R = H : 65%
R = OMe : 64%
PEG 2000 g : g&î'_°äo%
OH
o
HOHO
ou )'LN
N /
o
118 R = H 0
11c R = OMe
Figure 26 Schéma global de synthèse des composés 11a et 110
2016--03--02 19:31:31 Page 12/14 iGe--
Composé RME E global Industrie Tonnage Facteur E
Ha 22% 1199,0 Raffinerie de pétrole 106 -- 108 < 0,1 110 18% 1513,6 Chimie lourde 104 -- 106 1 -- 5 . . > 2 _ 4 _
Evaluation de la synthèse des Chlmle fine ... 10 5 50
composés 11a et 110 par les Industrie pharmaceutique 10 -- 103 25 -- 100
métriques de la chimie verte Facteur B des industries chimiques
Figure 27
Calculer le rendement global de la synthèse sur l'exemple du composé 11a et
commenter les chiffres obtenus
pour les indicateurs de la chimie verte. Quelle(s) améliorati0n(s)
proposeriez--vous pour abaisser le facteur E de
la synthèse proposée '?
Données (à 298 K)
Constantes
Constante d'Avogadr0 NA : 6,02 >< 1023 molf1 Constante de Faraday F : 96,5 >< 103 C-molÏ1 @ æ 0,059 V Constante des gaz parfaits R : 8,31 .1-1{*1'niol*1 Masses molaires en gmol"1 soude 40 carbonate de potassium (K2C03) 138 glucose 180 hydrogèn0carbonate de sodium 84 quinhydrone (C12H1004) 218 glycosylpropan0ne (compose l) 220 hydr0quin0ne (C6H602) 110 paratoluène sulfonatc de propargyle 210 1,4--benz0quinone (C6H402) 108 2',4'--dihydroxyacëtophénone 152 pentane--2,4--di0ne 100 2'--hydroxy--4'--propargyloxyacëtophénone (composé 4) 190 Constantes d'acidité Couple PhOH/PhOÎ COQ, HZO/HCOE HCOg/CO? H3PO4/H2POZ pK,, 9,95 6,4 10,3 2,2 Couple H2POZ/HPOÎ HPOÎ/POÎ NHî/NH3 acide gluconique / gluconate pKa 7,2 12,4 9,2 3,9 Couples d'omydoréductian et potentiels standards Couple Br2(aq,/Br(äq, 802 (aq) /HSOBÎ(aq) acide gluconique/ glucose 02 (@ /H20 E' (V) 0,34 1,90 0,07 1,23 Potentiel de l'électrode au calomel saturé (ECS) : E : 0,245 V. Données sécurité Réactif Pictogrammes Mention de danger Dibrome & Mortel par inhalation, provoque des brûlures de la peau, tres tox1que pour les orgamsmes aquatiques . . , Provoque une irritation cutanée, peut irriter les voies Tr1bromure de potass1um supporte . . resp1tat01res Dichlor0méthane Susceptible de provoquer le cancer 2016--03-02 19:31:31 Page 13/14 6"?-- Métriques de la chimie verte Economie d'atomes Efficacité de masse de la réaction Facteur environnemental avec M : masse molaire avec m : masse AE : Mproduit 2 M réactifs RME : mproduit î: anéactifs E * masse totale des déchets Signification de quelques abréviations masse du produit CuAAC réaction de cycloaddition entre azoture d'acyle et aleyne catalysée par le cuivre (I) AFO réaction d'Algar--Flynn--Oyamada (non étudiée) PCC chlorochromate de pyridium / \Ê _ H , ClCrOè E)th diéthylether EthiH triéthylsilane BFgOEt2 étherate de trifiuorure de bore O1 mCPBA acide mêtachioroperbenzoi'qne //0 O--O--H DIBAL hydrure de diisobutylammonium (C3H7)2A1H THF tétrahydrofurane ACOH acide acétique MeOH méthanol --Bn groupe benzyle Eæemples de structures de pyranoses (cycle à 6) et de fumnoses (cycle à 5) OH OH O O HO HO & HO HO OH OH OH H a--D--gh1copyranose fi--D--glucopyranose OH OH OH OH OH OH OH a--D--fructofuranose fl--D--fructofuranose . o . FIN . o c (ce)-- 2016--03--02 19:31:31 Page 14/14 Signature : (& Prénom= ______________________________________________ V , / Epreuve de Chimie Filière PC EÜNEÜUHS EENTHHLE°SUFËLEE ËËËËÎÊE : l\e rien porter sur cette feuille avant d'avoir rempli complètement l'en--tête réactifs produits > C.I'.
Figure A Profil réactionnel d'une réaction
@) (.
A dioxygène
Figure B Schéma de la biopile a glucose / dioxygène
2016--02--29 18 :31 :05
Ne flen écflre dansla parüe banée
2014«005-DR
075 .'
a5 .-
a25 -"
- . >E(V)/ECS
0,05 0,1 0,15 0,2 0,25
--0,25 .
--0,5 .
--0,75 ...,...0°
--1
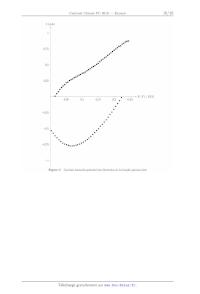
Figure C Courbes intensité--potentiel des électrodes de la biopfle glucose /
urée