Centrale Chimie PC 2015
| Thème de l'épreuve | Wacker, Heck, Tsuji et le palladium |
| Principaux outils utilisés | chimie organique, chimie de coordination, oxydoréduction, cristallographie, orbitales moléculaires, diagrammes E-pH |
| Mots clefs | palladium, diagramme potentiel-pCl, complexe plan carré, Nakamurol-A |
Corrigé
: 👈 gratuite pour tous les corrigés si tu crées un compte👈 l'accès aux indications de tous les corrigés ne coûte que 5 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)








Rapport du jury
(télécharger le PDF)


Énoncé obtenu par reconnaissance optique des caractères
Ü» Chimie LD
%, F|
_/ PCQ
cunnnuns EENTHHLE-SUPËLEE 4 heures Calculatrices autorisées N
Wacker, Heck, Tsuji et le palladium
« Les années 1950 voient le développement extraordinaire de la chimie des
métaux de transition avec la décou-
verte du ferrocène puis de réactions catalytiques qui leur sont associées. La
polymérisation de l'éthylène et du
propylène catalysée par des composés du titane (1952) et le procédé Wacker de
synthèse catalytique de l'éthanal
par oxydation sélective de l'éthylène (1959) ont contribué à cet essor avec
l'emploi des oléfines, matières pre-
mières de la pétrochimie naissante, et le palladium, métal qui va montrer sa
très grande versatilité en formation
de liaisons carbone--carbone. »
Igor Tkatchenko, Le couple palladium-carbone invité à Stockholm
L'Actualité Chimique n°346, 2010
Ce sujet présente le procédé Wacker, la réaction de Heck et une synthèse
présentant une étape d'oxydation
chimio--sélective (réaction de Wacker--Tsuji), trois réactions importantes qui
utilisent des complexes du palladium
comme catalyseur.
Le procédé Wacker a été mis au point dans l'entreprise allemande Wacker Chemie
et a débouché en 1957 sur un
brevet de réaction en phase gazeuse utilisant une catalyse hétérogène. Richard
Heck, chimiste américain né en
1931, a obtenu le prix Nobel en 2010, avec deux autres récipiendaires, pour les
réactions de couplage catalysées
par le palladium en synthèse organique. Jiro Tsuji, chimiste japonais né en
1927, a reçu de nombreux prix pour
ses apports dans le développement et les applications des réaction catalysées
par les métaux de transition en
synthèse organique.
Des réponses systématiquement justifiées et argumentées, mais concises sont
attendues.
Des données utiles à la résolution sont regroupées en fin d'énoncé.
I Le palladium métallique
Le palladium est un élément chimique faisant partie des platinoïdes. Il s'agit
d'un métal noble dont l'utilisation
majeure aujourd'hui concerne les convertisseurs catalytiques. Le principal
secteur consommateur de palladium
est l'industrie automobile (56% de la production mondiale) ; le palladium
intervient en effet, avec d'autres
composés, dans les pots catalytiques.
I.A -- Positionner le palladium (symbole Pd) dans la classification périodique
en indiquant son numéro
atomique, le numéro de la ligne, le numéro de la colonne et en explicitant la
méthode utilisée.
I .B -- Une consultation de Wikipédia donne ces indications concernant le
palladium métallique :
« Le palladium appartient au groupe 10 du tableau périodique des éléments mais
il possède une configuration
très atypique de ses couches électroniques périphériques par rapport au reste
des éléments du groupe mais aussi
par rapport a tous les autres éléments. Le palladium est un métal blanc argenté
mou semblable au platine. Il
est le moins dense des éléments du groupe du platine (ruthénium, rhodium,
osmium, iridium et platine). Les
états d'oxydation usuels du palladium sont 0, +1, +2 et +4. [..] Ce métal
possède la capacité rare d'absorber
jusqu'à 900 fois son propre volume de dihydrogène à température ambiante.
Rayon atomique : 140 pm ; structure cristalline : cubique à faces centrées. »
I.B.1) Apporter une analyse critique détaillée des indications données sur le
site wikipédia.
I.B.2) Évaluer la masse volumique du palladium ; commenter le résultat.
I.B.3) En déduire la masse de dihydrogène qui peut être absorbée par 1 kg de
palladium a la température
ambiante.
I.B.4) Citer une application du palladium en lien avec cette propriété
d'absorption citée dans l'extrait de
Wikipedia.
II Le procédé Wacker
Le procédé Wacker est utilisé industriellement pour produire en fort tonnage
l'acétaldéhyde (ou éthanal, précur-
seur de l'acide acétique et de l'anhydride acétique) en utilisant un catalyseur
à base de complexes de palladium
et de cuivre, en solution aqueuse, à 130 °C et sous 4 bars. On peut décrire le
cycle catalytique de la manière
suivante :
2015-02«27 09:14:53 Page 1/10 [_
[PdCIÎ] + C2H4 + H2O : CH3CHO + Pd + 2 HCl + 2 Cl--
Pd + 2 CuCl2 + 2 Cl* : [PdClâ'] + 2 CuCl
4CuCl + 02 + 4HCl : 4CuCl2 + 2H20
II.A -- Analyse du procédé
II.A.1) Écrire l'équation de la réaction modélisant la transformation de
l'éthylène en éthanal dans le procédé
Wacker.
II.A.2) Quelles sont les transformations subies par les espèces du palladium et
du cuivre lors des différentes
étapes du cycle catalytique ? Quelle doit être la ou les condition(s) sur les
potentiels d'oxydo--réduction pour
que les étapes du procédé Wacker soient thermodynamiquement possibles ?
II.A.3) Justifier l'appellation « cycle catalytique >> attribuée à la
succession des réactions intervenant dans le
procédé Wacker. Peut--on identifier un catalyseur et un co--catalyseur ?
II.A.4) Analyser ce procédé en termes de « chimie durable » (2 a 3 arguments
sont attendus).
II.B -- Influence des ligands chlorure sur les propriétés oæydo-réductrices
On se place dans cette sous-partie en milieu aqueux à température constante T =
298 K.
II.B.1) Instabilité du cuivre (I) dans l'eau
a) Justifier, par le calcul d'une constante d'équilibre adaptée et en fonction
des données fournies, que le cuivre
au degré d'oxydation (I) est instable en solution aqueuse. Cette justification
est-elle valable quel que soit le pH ?
b) Quel est le potentiel pris par une lame de cuivre plongeant dans une
solution contenant des ions cuivre (Il),
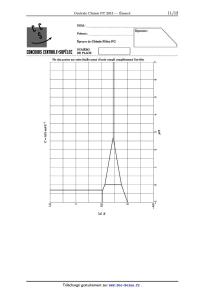
Cu2+, a la concentration molaire de 1><10_2 mol--L'1 ? II.B.2) Influence des ions chlorure sur la stabilité du cuivre (I) en solution Les frontières du diagramme potentiel--pCl (pCl : -- log[CÎ]) du cuivre sous ses divers degrés d'oxydation (O, I et Il) sont représentées figure 1. Ce diagramme prend en compte le cuivre métallique, les ions libres, le précipité CuCl et les complexes solubles CuClg et CuClZ. Il a été tracé pour une concentration totale en élément cuivre égale à 1>< 10_2 mol-L'1 et il est reproduit dans le document réponse. 1,5 1 5 0,5 51 0 _075 _ --1 0 1 2 3 4 5 6 7 1001 Figure 1 Frontières du diagramme E -- 1101 du cuivre a ) En utilisant le diagramme, discuter de l'influence des ions chlorure sur la stabilité du cuivre (I) en solution. () ) On introduit dans un litre d'eau les espèces chimiques suivantes : 1><10_2 mol"1 d'ions Cu2+, 1><10_1 mol d'ions chlorure et un excès de cuivre métallique. Donner la composition du mélange obtenu à l'équilibre. En déduire les coordonnées du point P associé au mélange dans le diagramme E -- 1901 lorsque le système est à l'équilibre. II.B.3) Influence des ions chlorure sur la réalisation du procédé Wacker a) Établir le diagramme de prédominance du palladium au degré Il, en représentant les domaines de prédo- minance du palladium (II) libre et du palladium (II) complexé par les ions chlorure en fonction de 1001. On supposera égale à 1>< 10_2 mol-L'1 la concentration molaire totale en élément palladium en solution. b) Dans quel domaine du diagramme E -- 1901 la condition du procédé Wacker concernant les propriétés oxydo--ré- ductrices relatives au palladium et au cuivre est-elle vérifiée ? On pourra s'appuyer sur le tracé d'un diagramme E -- 1001 ou sur toute autre méthode. Commenter le résultat obtenu en référence avec le cycle catalytique du procédé Wacker. 2015-0227 09:14:53 Page 2/10 [_ II.C -- Structure et réactivité du compleæe de palladium impliqué dans le procédé Wacker Le complexe PdClî" joue un rôle essentiel dans le procédé Wacker et dans un certain nombre d'autres cycles catalytiques. Les solutions aqueuses contenant ce complexe sont aussi utilisées dans la préparation de nombreux complexes par substitutions successives des anions chlorure. Le complexe PdClÎ présente une géométrie plan carré dont on se propose d'étudier la réactivité a partir du diagramme d'orbitales moléculaires (OM) obtenu par la méthode des fragments. Les axes des a: et des y passent par le métal et deux ligands chlorure opposés et l'axe 2 est perpendiculaire au plan de la structure passant par le métal comme représenté en figure 2. On suppose que les ions chlorure sont des ligands << a donneurs » n'intervenant que par une seule orbitale atomique (OA) dans la formation du complexe. Z \ X\ /X/>y
X//M\ /
/ X
\oe
Figure 2 Axes des a: et des y passant par le métal M et deux ligands X opposés
et axe des 2
perpendiculaire au plan de la structure passant par le métal
II.C.1) Structure électronique du complexe PdClî"
Quel est le nombre d'électrons de valence du palladium engagé dans le complexe
PdClâ" ?
II.C.2) Diagramme d'orbitales moléculaires du complexe plan carré
Fragment diatomique
a) Représenter le diagramme d'orbitales moléculaires de X2 obtenu par la
combinaison de deux orbitales ato-
miques identiques de X. On supposera, par souci de simplification, ces
orbitales atomiques sphériques. On
indiquera la lettre S pour Symétrique ou A pour Antisymétrique pour les
orbitales moléculaires obtenues.
Fragment plan carré
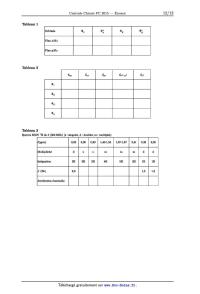
b ) Le diagramme d'orbitales moléculaires d'un fragment << plan carré » X 4 obtenu par la combinaison de quatre orbitales atomiques sphériques identiques est représenté figure 3. Extraire de ce diagramme les << OM diatomiques X2 » qui interagissent lors de la formation du fragment X 4. Ces << OM diatomiques X2 » seront notées \IIOE, \Il;, \I!y et \I!; et représentées sur la copie à partir du système d'axes défini précédemment. E ----ÆPÆ wi Figure 3 Orbitales d'un fragment << plan carré » X 4 c ) Justifier les interactions entre << OM diatomiques X 2 » en complétant le tableau 1 (reproduit sur le document réponse) par les lettres S ou A pour indiquer la symétrie ou l'antisymétrie par rapport aux plans oez et yz. 2015-02«27 09:14:53 Page 3/10 [_ ___---- Plan yM z Tableau 1 Complexe M X 4 On étudie maintenant les interactions entre les orbitales atomiques d du métal M et les orbitales du fragment X 4. On suppose que chaque ligand apporte deux électrons dans la formation du complexe. Le diagramme d'orbitales moléculaires du complexe M X 4, obtenu par la méthode des fragments à partir des interactions entre les orbitales atomiques 4d, 5s et 5p du métal M et les orbitales du fragment X 4 précédent, est représenté figure 4. 1 _\ ,,3 xl2 // \\ /// \ // \\ , /,' 1], \ \ ,' ,' \ '\ / / \ // // \ \ ,' / \ \ / / \ \ , , \ " /' 10\ \ 5p '--------------"'7 """" \ \ \ / \ \\ \ / \ // \\ \\ \ ' \ \ ,' 9_\ \ \ \ / \ \ \ \ ,' \ \ \ \, \ \ \ //\ \\ \ \ / \ \ \ \ / \ \ \ \ ' \ \ \ 5S_'--___ \ \ \\ \ ----\__ \ \ \ '----\ \ \ \ --------__ \ \ \\ '---- \ \\ --_\8 \ \\ \ \ \ \ \ \ \\ \ \ \ \\ \ \ \ \ \ \ \ \ \ \ \\ \ \ \ \ \ \ \ \ \ \\ \ \ \ \ _ \ \ _ \ 7_--6 \ \ \\ 4d= \ 5-- \ \ \ _ \\ \\ \ \\ \ \ ' \\ \ \ \\ \ \ \ \ \ \\ \ \ \ \\ . . \ \ ' _-- Orb1tales atom1ques '\ \_\_ _ _ ,... -- T\ \ _----"' \ \ du métalM \ 4 ______ \ \ \ \ \ \ ' \ \\ \ '-- \ \__\_-À_ \ ___----'\ \ \--_3 "'--'-- \\\ ____--' \ 2 \\ \\ )-- , /, /, , /" /, , , ' ' Orbitales du fragment // / ,» plan carre X4 /, ,, /, 1 Figure 4 Diagramme d'orbitales moléculaires du complexe M X 4 obtenu par la méthode des fragments (les pointillés représentant les contributions des orbitales atomiques d du métal M n'ont pas été représen- tées) d ) Déterminer la nature des orbitales d du métal qui interagissent avec les orbitales du fragment X 4 (notées par ordre d'énergie croissante \I!1, \112 et '113 qui sont dégénérées et \Il4). Compléter le tableau 2 (reproduit sur le document réponse) en indiquant dans les cases correspondantes le mot << oui >> si les orbitales interagissent ou
en laissant les cases vides si les orbitales n'interagissent pas.
dæ2 2 dz2
_?!
Tableau 2
20150237 09:14:53 Page 4/10 [_
e) Les complexes plan carré à seize électrons ont une stabilité maximale.
Proposer une interprétation a cette
propriété.
f ) Identifier, dans ce cas de stabilité maximale, les orbitales frontalières
du complexe M X 4.
g) Extraire du diagramme d'énergie et représenter qualitativement le diagramme
d'orbitales moléculaires du
« groupe d » contenant les 5 OM où les OA d du métal sont les plus
contributives (ce groupe comprend donc
entre autres les orbitales frontalières).
h) Expliquer pourquoi les complexes de ce type réagissent avec des substrats
électrophiles perpendiculairement
au plan du complexe.
III La formation de liaisons carbone--carbone et la réaction de Heck
Répondre aux questions de cette partie après lecture des extraits d'articles et
d'ouvrages reproduits ci--dessous.
Création de liaisons carbone--carbone
La création de liaisons carbone--carbone est un préalable à toute forme de vie,
tout au moins sur la Terre.
C'est une préoccupation constante des chimistes depuis le développement
d'outils de synthèse organique
dans la seconde moitié du XIXe siècle -- outils qui ont conduit à l'élaboration
de molécules de plus en plus
complexes ou aux structures étonnantes, mais aussi à la production industrielle
de combustibles, fibres
artificielles, matériaux, médicaments...L'importance de ces outils pour le
développement scientifique et
technologique explique le grand nombre de prix Nobel décernés pour la
découverte de nouvelles méthodes
de création de liaisons C-C : les organomagnésiens (Grignard, 1912), la
réaction de Diels-Alder (Diels
et Alder, 1950), la polymérisation Ziegler-Natta (Ziegler et Natta, 1963), la
réaction de Wittig (Wittig,
1979) et l'hydroboration (Brown, 1979), la méthathèse des oléfines (Chauvin,
Grubbs et Schrock)...
Si l'emploi des organomagnésiens a conduit à de très nombreuses applications en
synthèse organique, il est
souvent limité par des incompatibilités réactionnelles avec certains
groupements portés par le partenaire
électrophile, groupements qu'il faut protéger puis éliminer la protection une
fois la réaction de couplage
croisé accomplie. En outre, avant même que l'on ne parle de chimie pour le
développement durable, le
chimiste se préoccupait déjà du bilan de matière des réactions. Les
sous-produits engendrés, dont un
équivalent de sels de magnésium par molécule formée, constituent un handicap
certain au développement
de procédés viables...
Métal de transition et création de liaisons carbone--carbone
Deux manifestations essentielles président à la spécificité des métaux de
transition en création de liaisons
C-C :
-- la réaction d'addition oxydante résultant de l'interaction d'un réactif
électrophile R-X avec un centre
métallique suffisamment riche en électrons ;
-- l'interaction métal-oléfine permettant une activation temporaire de
l'oléfine qui de nucléophile, peut
devenir suffisamment électrophile dans ce processus d'umpolung (mot allemand
signifiant renverse--
ment de polarité).
Les combinaisons possibles de ces processus sur le même centre métallique
permettent l'interaction entre
les deux entités carbonées, puis la création d'une liaison carbone--carbone du
fait de cet effet de proximité
par réaction d'élimination réductrice (deux radicaux carbonés) ou d'insertion
migratoire (radical carboné
et oléfine).
Dans ses états d'oxydation usuels, le palladium est un excellent compromis pour
permettre ces deux
événements qui vont conduire au couplage croisé.
La réaction de Heck
En s'inspirant de l'étape--clé du procédé Wacker, l'interaction entre un ligand
hydroxo et un ligand éthy-
lène lié au centre palladium, Heck publie en 1968 une série de publications sur
l'addition à température
ambiante du mêthyl-- ou du phénylpalladium sur l'éthylène : cette réaction
produit du palladium (0) qu'il
faut réoxyder, comme dans le procédé Wacker, pour fournir un sel de palladium
susceptible de réagir par
transmétallation avec un organomercurique RHgX pour obtenir le réactif palladié.
La découverte de la réaction d'addition oxydante d'halogénures d'arer sur le
palladium a ensuite conduit
Heck a proposer une version catalytique de cette réaction où l'acide HX produit
est piégée par une base
telle que la triéthylamine ; la réaction de Heck était née.
Elle connaîtra à partir des années 1990 un intérêt grandissant en synthèse de
plus d'une centaine de
produits naturels, de principes actifs de médicaments comme le naxoprène et le
Taxol®, d'herbicides
comme le Prosulfuron®, ou de matériaux pour l'électronique comme le Cyclotène®.
Le cycle catalytique de la réaction de Heck comporte cinq étapes qui sont
reproduites sur le schéma
ci--dessous :
2015--02--27 09:14:53 Page 5/10 E°
III.A -- Création de liaisons carbone-carbone
Illustrer, sur des exemples concrets, deux types de réaction qui n'utilisent
pas les métaux de transition et
permettent de créer des liaisons carbone--carbone.
III.B -- Stratégie réactionnelle et économie d'atomes
III.B.1) Proposer une séquence réactionnelle mettant en oeuvre un
organomagnésien et permettant de réaliser
la transformation représentée sur la figure 5.
/ 0 / DH
0 _,0
DE!
Figure 5
III.B.2) Cette synthèse présente-t-elle des inconvénients en termes de
chimiosélectivité et d'économie d'atomes ?
2015-02-27 09:14:53 Page 6/10 @ BY--NC--SA
III.C -- Réaction de Heck
III.C.1) Equation de réaction de Heck
Écrire l'équation de la réaction de Heck sur l'exemple décrit dans l'extrait de
l'ouvrage Introduction à la chimie
moléculaire des éléments de transition. Cette équation est--elle conforme au
cycle catalytique représenté dans
l'article de L'Actualité Chimique ?
III.C.2) Cycle catalytique
Donner la nature des réactions mises en jeu dans chacune des étapes du cycle
catalytique.
III.C.3) Évolution du degré d'oxydation du métal
Déterminer la variation du degré d'oxydation du métal au cours de la première
étape du cycle catalytique.
III.C.4) Activation de l'alcène
Proposer un schéma modélisant l'interaction entre les orbitales W et 7r* de
l'alcène et les orbitales d du métal
pour expliquer la modification de réactivité de l'alcène.
IV Une application du palladium en synthèse : l'oxydation de Wa--
cker-Tsuji
Parmi les méthodes de recherche de nouveaux principes actifs par les
laboratoires pharmaceutiques, une des
stratégies possibles est de recenser les molécules synthétisées par des
organismes vivants. Cette stratégie suppose
de purifier des extraits naturels, de déterminer la structure des différentes
molécules isolées, de tester leur
activité dans un contexte précis (activité antibiotique, antitumorale, etc.)
puis d'en réaliser la synthèse lorsque
les ressources naturelles ne permettent pas une extraction viable d'un point de
vue économique ou écologique.
Le nakamurol-A est un terpénoïde naturel possédant un squelette carboné
original qui a été isolé en 1996 à partir
d'une éponge, Agelas nakamurai, récoltée à Okinawa (Japon). Sa synthèse totale
sous forme racémique, publiée
en 2000 par une équipe espagnole[l][2], avait pour but de mettre au point une
stratégie de synthèse générale
des diterpénoïdes de cette famille nouvelle ainsi que de valider des hypothèses
sur la stéréochimie supposée de
la molécule naturelle.
Cette synthèse totale est basée sur trois étapes-clés : une addition
diastéréosélective d'un organozincique sur une
énone endocyclique, une allylation de Sakurai d'une énone exocyclique ainsi
qu'une oxydation chimiosélective de
Wacker-Tsuji. Cette dernière étape--clé illustre une application en synthèse
organique fine de ce type d'oxydation
catalysée par des complexes du palladium.
Références de la synthèse :
[1] Josep Bonjoch, Javier Cuesta, Sandra Diaz and Asensio Gonzalez, Total
synthesis of (i)-nakamurol--A
and its 13-epimer : tentative assignment of the 0--13 relative configuration,
Tetrahedron Letters, 41,
(2000) 5669--5672.
[2] Sandra Diaz Fité, Sintesis enantioselectiua y elucidaciôn configuracional
de los temenoides Nakamurol
A y Xilarenal A, Thèse de doctorat, Universitat de Barcelona, 2004.
I V.A -- Passage de la décalone 3 au nakamurol-A ( étapes finales de la
synthèse)
Ces étapes finales sont schématisées figure 6. Me désigne le groupe méthyle.
CH20H
Me
0 0
1] Main. Ni(flcac]2v LiBr, Eî20 1] MSCI, iPQEÎN
2) H :] DBU. THF 5(014H220'
FO puis hydrolyse
M Me H Ma
9
3 Me 4
Figure 6
IV.A.1) Analyser la réactivité de la décalone 3 et de l'organométallique
(H30)2Zn et proposer un mécanisme
plausible pour le passage de la décalone 3 au composé 4. On ne tiendra pas
compte du rôle du complexe de
nickel ou de LiBr et on ne cherchera pas a expliquer la régio-- ou la
stéréo-sélectivité de cette étape.
IV.A.2) Quel est le produit 4h de la réaction entre le chlorure de
méthanesulfoner ou chlorure de mésyle MSC]
et 4 ? Quel est le rôle de l'amine iPr2EtN utilisée dans cette étape ?
IV.A.3) Le DBU dont la formule topologique est représentée figure 7, est une
base peu nucléophile. Justifier
cette propriété et indiquer le site responsable des propriétés basiques.
2015-02«27 09:14:53 Page 7/10 [_
"3
N
Figure 7
IV.A.4) Donner la structure du composé 5 et proposer un mécanisme rendant
compte de sa formation.
IV.A.5) Pour obtenir le composé 5, après l'action du chlorure de mésyle, on met
en oeuvre le mode opératoire
suivant. Une solution de 175 mg (0,58 mmol) de composé 4h dans 10 mL de THF est
traitée par 0,2 mL de DBU
(densité d = 1,0) et portée à reflux pendant 15 heures. Après refroidissement,
le mélange est dilué a l'éther et
lavé avec de l'acide chlorhydrique a 2 mol-L'1, puis avec une solution aqueuse
saturée de chlorure de sodium. La
phase organique est séchée et les solvants sont évaporés pour conduire à une
huile purifiée par chromatographie
sur colonne (éluant hexane/acétate d'éthyle 95/ 5) pour obtenir le composé 5
(119 mg).
Un spectre RMN 1H du composé 5 est réalisé (300 MHz) (s : singulet, d :
doublet, m : multiplet). Le tableau 3
en donne quelques caractéristiques.
ô(ppm) 0,83 0,90 0,99 1,40--1,53 1,67-1,87 2,41 5,28 6,06
Multiplicité d s s m m m d d
Intégration 3H 3H 5H 2H 1H
J (Hz) 1,5
6,9 1,5
Attribution éventuelle
Tableau 3
a ) Expliquer l'intérêt des opérations de lavage et le choix des solutions de
lavage utilisées.
b ) Comment peut--on sécher la phase organique ?
c) Quelle technique de purification, alternative a la chromatographie sur
colonne, pourrait-on proposer ?
d) Interpréter les principales caractéristiques du spectre RMN du composé 5 en
complétant, dans le tableau
3 du document réponse, la ligne « Attribution éventuelle >> avec une lettre
désignant clairement un groupe de
protons du composé 5.
e) Commenter les quantités de réactifs introduites et déterminer le rendement
de l'étape 2) du passage du
composé 4 au composé 5.
IV.A.6) La construction des chaînes latérales se poursuit comme indiqué figure
8. Le passage de 5 à 6 n'est
pas étudié. Proposer un réactif permettant de transformer le composé 6 en
composé 7.
/ /
Me Me
0
1) CH2=GHCHZSiM93, TiCl4
5 C H 0 --b _
'l 14 22 )2]KF,EtOH
Ma ...
Ma 6 Me 7
Figure 8
IV.A.7) Le procédé Wacker étudié précédemment a été appliqué en synthèse
organique fine a l'oxydation
sélective des alcènes terminaux (monosubstitués). De bonnes sélectivités en
faveur de l'oxydation en cétone
sont obtenues en présence de DMF (oxydation de Wacker--Tsuji). L'oxydation des
alcènes non terminaux est
impossible sauf s'ils sont conjugués avec un carbonyle. Ce procédé est employé
dans l'étape suivante de la
synthèse étudiée présentée figure 9.
0
Me
PdCIE (D. 33 èq]. CuGl. 0;
_J--
DMP. H20
Me 8
Me
Figure 9
2015-02«27 09:14:53 Page 8/10 [_
Quelle autre séquence aurait pu permettre de transformer l'alcène en cétone ?
Pourquoi ne peut-on pas l'utiliser
dans cette synthèse ?
IV.A.8) Comment peut--on obtenir le Nakamurol--A a partir du composé 8 ?
I V.B -- Synthèse de la décalone 3
Les premières étapes de la synthèse étudiée consistent en l'obtention de la
décalone 3 sous forme racémique.
IV. B. 1) Obtention de la lactone 2
Signification des abréviations utilisées. LDA: diisopropylamidure de lithium,
Li+ ,2N(CH(CH3) )2 ;:Me mé-
thyle; t--Bu: tert-- butyle, --C(CH3)3' , AcONa: éthanoate de sodium, Ac2O:
anhydride éthanoiquâ
Le passage du composé 1 (sous forme racémique) a la lactone 2, représenté sur
la figure 10, est très peu détaillé
dans la publication originale: seuls les réactifs sont précisés pour chaque
étape, aucun composé intermédiaire
, ,
n est donne.
0 0 0
1) HCDQEt, Na0Me
2) N-méfl1ylaniline
3) LDA. Mel
_)--
4) f-BUOK, Br(C H2)2002El
5) HCI
6) NaOH Me
Me 7) AcONa. Aozo Me
Figure 10
Pour comprendre la stratégie des auteurs, on se propose d'étudier une séquence
modèle simplifiée présentée
figure 11.
0 A) LDA, Mel ° 0
B) t--BuOK, Br(CHË)2002Et
--.--
c; NaOH
D) AcONa. A020
lb ... 2»
Figure 11
a) Procéder à une analyse de cette séquence : préciser la nature des réactions,
proposer une structure pour les
composés intermédiaires. Etudier les problèmes de sélectivité posés par
certaines étapes.
() ) Quels problèmes supplémentaires de sélectivité sont posés si on part du
réactif 1 et qu'on applique la même
séquence modèle (réactions A à D) ?
c ) On admet que les étapes supplémentaires (non étudiées) effectuées par les
auteurs ont pour objectif de fixer
de manière réversible un groupe protecteur en alpha du carbonyle du composé 1
selon le schéma de la figure 12.
0 . 0
protecüon
__--
___--
dépmæction Jl\/x
Figure 12
Analyser la stratégie de synthèse suivie et proposer une interprétation a la
stéréosélectivité observée pour le
passage du composé 1 a la lactone 2.
IV.B.2) Passage de la lactone 2 à la décalone 3
Les étapes 8 et 9 de la synthèse sont données figure 13. Proposer un mécanisme
pour ces deux étapes.
0
B) CH3Li
9) KOH. EtOH
Me
Me
3
Figure 13
2015-0227 09:14:53 Page 9/10 [_
DONNÉES
Données à 298 K.
Eoetmit du tableau périodique (masses molaires en g-mol'1, masses volumiques en
g-cm'3)
Numéro atomique 1 6 7 8 12 30 53
Symbole H C N O Mg Zn 1
Masse molaire 1,01 12,0 14,0 16,0 24,3 65,4 127
Masse volumique 1,74 7,13
Constantes
Constante d'Avogadro N A = 6,02 >< 1023 mol"1 Constante de Faraday F = 96,5 >< 103 C-mol"1 Constante des gaz parfaits R = 8,31 J --K"1--mol_1 Tl 1 On prendra w % 0,059 V à 298 K. F Potentiels standard Couple Cu+ / Cu Cu2+ /Cu+ Pd2+ /Pd E° (V) 0,52 0,16 0,92 Constantes de formation des compleæes mua-- Produit de solubilité Produit de solubilité Ks du précipité CuCl : sz : 6,7 Economie d 'atomes L'économie d'atomes est un nombre (exprimé en %) défini comme le rapport de la masse molaire du produit recherché sur la somme des masses molaires des réactifs utilisés (en tenant compte des nombres stoechiomé- triques). Déplacements chimiques Quelques déplacements chimiques en RMN du proton (proton correspondant noté en gras) -CH2-OH o= c--cn «JH--OH "... 5,0 6,0H ppm 0,5- 5,5 ppm 2,1 2,6 ppm 1,6 2,0 ppm 3,2- 3,6 ppm 0,8 1,6 ppm oooFlNooo 2015-02«27 09:14:53 Page 10/10 [_ ç, % NOM= ................................................................................................................. ('a Prénom= __________________________________________________________________ V , / Epreuve de Chimie Filière PC cnucnunsæumnoe-surëoec ËË"ËËÎä : Ne rien porter sur cette feuille avant d'avoir rempli complètement l'en--tête C' = 0,01 mol-L"1 3 pCl 1,5 --0,5 2015-02-25 11 :34 :41 Ne rien écrire dans la partie barrée 20 14--006-DR Tableau 1 Orbitale 'I'æ \I/î \Ily \II; Plan æMz Plan yMz Tableau 2 \Ij4 Tableau 3 Spectre RMN 1H de 5 (300 MHZ) (s : singulet, d : doublet, m : multiplet) 5(ppm) IM 0,99 1,40-1,53 1,67--1,87 5,28 6,06 J (Hz) 6,9 1,5 1,5 Attribution éventuelle