Centrale Chimie PC 2008
| Thème de l'épreuve | Propriétés et utilisations des ions cyanure. Synthèse du cholestérol. |
| Principaux outils utilisés | orbitales moléculaires, solutions, cinétique, synthèse organique |
| Mots clefs | cholestérol, Woodward, Lapworth, cyanure, diagramme d'orbitales moléculaires, E-pCN, Diels-Alder, aldolisation |
Corrigé
: 👈 gratuite pour tous les corrigés si tu crées un compte👈 l'accès aux indications de tous les corrigés ne coûte que 5 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)







Rapport du jury
(télécharger le PDF)


Énoncé obtenu par reconnaissance optique des caractères
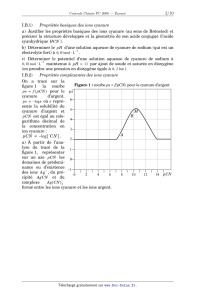
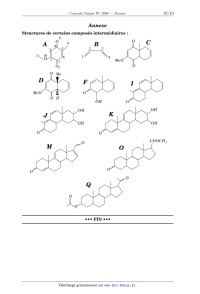
Concours Centrale - Supélec 2008 Épreuve : CHIMIE Filière PC CHIMIE Filière PC CHIMIE Calculatrices autorisées. Partie I - Propriétés et utilisations des ions cyanure Les données utiles à cette partie sont rassemblées à la fin de celle-ci. I.A - Étude structurale I.A.1) Propriétés atomiques a) Rappeler la structure électronique de l'atome de carbone dans son état fondamental. b) Comparer, en justifiant la réponse, l'électronégativité de l'atome de carbone à celle de l'atome d'azote. I.A.2) Schéma(s) de Lewis a) Proposer un schéma de Lewis des ions cyanure ( CN ) qui satisfasse aux règles de stabilité maximale. b) Peut-on proposer une forme mésomère de la structure précédente ? I.A.3) Diagramme d'orbitales moléculaires a) Sachant qu'il s'agit d'un diagramme non corrélé, donner l'allure du diagramme d'orbitales moléculaires de la molécule de dioxygène. Placer les électrons dans les différents niveaux obtenus. b) Sachant qu'il s'agit d'un diagramme corrélé, donner l'allure du diagramme d'orbitales moléculaires de la molécule de diazote. Placer les électrons dans les différents niveaux obtenus. c) Le diagramme d'orbitales moléculaires de la molécule C 2 serait-il corrélé ou non corrélé ? Justifier la réponse. d) Justifier la position relative des orbitales atomiques de valence des atomes de carbone et d'azote. e) Proposer, en justifiant la réponse, un diagramme d'orbitales moléculaires pour l'ion cyanure. Placer les électrons dans les différents niveaux obtenus. I.B - Propriétés basiques des ions cyanure -- Application en hydrométallurgie On se propose d'étudier les propriétés basiques des ions cyanure et d'analyser le principe d'extraction métallurgique de l'argent par cyanuration. Concours Centrale-Supélec 2008 1/10 CHIMIE Filière PC Filière PC I.B.1) Propriétés basiques des ions cyanure a) Justifier les propriétés basiques des ions cyanure (au sens de Brönsted) et préciser la structure développée et la géométrie de son acide conjugué (l'acide cyanhydrique HCN ). b) Déterminer le pH d'une solution aqueuse de cyanure de sodium (qui est un 1 électrolyte fort) à 0, 01mol L . c) Déterminer le potentiel d'une solution aqueuse de cyanure de sodium à 1 0, 01mol L maintenue à pH = 11 par ajout de soude et saturée en dioxygène (on prendra une pression en dioxygène égale à 0, 2 bar ). I.B.2) Propriétés complexantes des ions cyanure On a tracé sur la Figure 1 : courbe ps = f(pCN) pour le cyanure d'argent figure 1 la courbe ps = f ( pCN ) pour le ps cyanure d'argent. 6 ps = log s où s représente la solubilité du cyanure d'argent et 5 M B pCN est égal au colo4 garithme décimal de la concentration en 3 ion cyanure : A pCN = log [ C N ] . 2 a) À partir de l'analyse du tracé de la 1 figure 1, représenter sur un axe pCN les 0 domaines de prédominance ou d'existence 1 + des ions A g , du pré0 4 6 8 10 12 14 pCN 2 cipité AgCN et du complexe Ag ( CN ) 2 formé entre les ions cyanure et les ions argent. Concours Centrale-Supélec 2008 2/10 CHIMIE Filière PC b) Déterminer à l'aide de la courbe la valeur du produit de solubilité du cyanure d'argent. c) Retrouver par un calcul approprié l'équation de la droite AB et les coordonnées du point M qui correspond au maximum de la courbe. I.B.3) Diagrammes potentiel- pCN a) Tracer le diagramme potentiel- pCN pour le couple Ag ( I ) / Ag pour des valeurs de pCN comprises entre 0 et 16 . On considérera une concentration 1 totale en argent ( I ) dissous de 0, 01mol L . On adoptera impérativement les échelles suivantes : abscisse 1 cm par unité de pCN ; ordonnée : 1 cm pour 0, 2 V . L'axe des potentiels sera compris entre 1, 4 et 1, 4 V . b) Superposer au diagramme précédent celui du couple Zn ( II ) / Zn . On prendra 1 égale à 0, 01mol L la concentration totale en zinc ( II ) dissous. Application en hydrométallurgie I.B.4) On traite un minerai argentifère (contenant de l'argent à l'état natif) par une solution aqueuse de cyanure de sodium en équilibre avec le dioxygène atmosphérique (on prendra une pression en dioxygène égale à 0, 2 bar ). On considère 1 que la concentration en ions cyanure est maintenue à 0, 01mol L et le pH est constant et fixé à pH = 11 par ajout de soude. a) À partir de l'étude menée aux questions précédentes, écrire l'équation-bilan de la réaction de lixiviation de l'argent métallique contenu dans le minerai. b) La solution obtenue après lixiviation est traitée par de la poudre de zinc. Quel est le résultat de cette opération ? Écrire l'équation-bilan correspondante. Comment nomme-t-on cette opération ? I.C - Propriétés nucléophiles des ions cyanure -- Formation de cyanhydrines L'addition d'acide cyanhydrique sur un composé carbonylé conduit à un hydroxynitrile encore appelé cyanhydrine. I.C.1) Bilan réactionnel Écrire l'équation-bilan de l'addition d'acide cyanhydrique sur l'éthanal et nommer le produit formé. I.C.2) Étude qualitative du mécanisme La formation des cyanhydrines a constitué un précurseur de la chimie mécanistique. En 1903, la réaction est déjà connue mais le chimiste Arthur Lapworth se propose d'en étudier le mécanisme. Pour se faire, il va réaliser une étude cinétique avec les moyens dont il dispose : sa montre et ses yeux. Il suit l'avancement de la réaction grâce à la couleur jaune intense qui disparaît. En effet, la camphorquinone, qui est la cétone de départ utilisée par Lapworth, est jaune Concours Centrale-Supélec 2008 3/10 CHIMIE Filière PC intense (la couleur persiste même à faible concentration). La cyanhydrine formée étant incolore, il suffit à Lapworth de noter le temps nécessaire à la décoloration. Il obtient les résultats suivants : · ce temps est de 8 à 10 heures dans le cas de la mise en présence des deux réactifs ( HCN et la cétone) ; · s'il ajoute de l'acide chlorhydrique, il n'observe pas de décoloration, même après 14 jours ; · s'il ajoute 1 goutte de potasse à 15%, la décoloration se produit au bout de 15 secondes ; · s'il ajoute de l'ammoniaque, la décoloration prend quelques minutes ; · de même, s'il ajoute du cyanure de potassium, la réaction est accélérée. À partir de ces résultats, Lapworth considère qu'a priori trois mécanismes sont envisageables (on notera RRCO la cétone de départ et C la cyanhydrine formée à partir de cette cétone) : Mécanisme A Protonation de la cétone puis addition nucléophile des ions cyanure sur la cétone protonée H R R O +H + O R R équilibre instantané de constante K H R O R + CN C constante de vitesse k A Mécanisme B Addition nucléophile des ions cyanure sur la cétone puis protonation du produit formé R R NC R O + CN R R NC R O +H + Concours Centrale-Supélec 2008 O C constante de vitesse k B équilibre instantané de constante K 4/10 CHIMIE Filière PC Mécanisme C Acte élémentaire bimoléculaire R O +HCN C constante de vitesse k C R a) Déterminer, en fonction des constantes de vitesse, des constantes d'équilibre + et des différentes concentrations (en cétone, en ion H , en HCN et C N ), l'expression de la vitesse de chacun des trois mécanismes A , B et C . b) Montrer que l'analyse qualitative des résultats obtenus par Lapworth permet d'éliminer l'un des trois mécanismes. I.C.3) Étude quantitative de la cinétique réactionnelle On étudie la cinétique de formation de la cyanhydrine synthétisée par addition de l'acide cyanhydrique sur l'éthanal à T = 298 K dans un milieu tamponné à pH = 4, 2 pour une concentration initiale en HCN notée C 0 et une concentration initiale en éthanal notée C 0 . Les résultats obtenus sont consignés dans le tableau suivant ( t 1 / 2 représente le temps de demi-réaction) : expérience n° 1 2 3 4 5 C 0 ( mol L ) 0, 20 0, 10 0, 05 0, 10 0, 10 C 0 ( mol L ) 1 0, 01 0, 10 0, 05 0, 005 t1 / 2 ( s ) 660 1900 3800 1320 1 0, 001 1320 a) Déterminer, dans ces conditions expérimentales choisies, l'ordre global de la réaction et l'ordre partiel par rapport à chaque réactif. Déterminer la valeur de la constante de vitesse apparente (notée k app ). On notera la vitesse de la réac tion sous la forme : v = k app [ HCN ] [ CH 3 CHO ] . b) Pour chacun des trois mécanismes A , B et C , envisagés par Lapworth, donner dans les conditions de l'expérience ( pH = 4, 2 notamment) l'expression de chaque vitesse en fonction des constantes de vitesse, des constantes d'équilibre + et des concentrations en cétone, en ion H et en HCN uniquement. Les résultats expérimentaux concernant les ordres partiels sont-ils en accord avec les schémas mécanistiques retenus ? c) Pour valider la nature du mécanisme de formation de la cyanhydrine, on détermine la constante de vitesse apparente k app à différentes valeurs de pH . Les résultats sont consignés dans le tableau suivant : Concours Centrale-Supélec 2008 5/10 CHIMIE Filière PC pH 4, 2 k app ( L mol 1 1 s ) 4, 3 6, 7 10 4, 5 3 1, 09 10 4, 8 2 2, 07 10 2 Montrer qu'une simple analyse de ces valeurs permet d'éliminer deux des mécanismes proposés puis montrer par le tracé d'une droite adaptée que la dépendance de k app avec le pH de la solution est validée pour le mécanisme restant. d) Réécrire le mécanisme retenu en le complétant par les mouvements électroniques adéquats. Données : Dans tout le problème T = 298 K . On prendra 2, 3 RT / F = 0, 06 V ; numéro atomique C 6 ; N 7 ; O 8 ; énergie des orbitales atomiques de valence ( eV ) : C 19, 4 et 10, 7 ; N 25, 6 et 12, 9 ; O 32, 4 et 15, 9 . On note K a la constante d'acidité du couple (acide cyanhydrique HCN /cyanure C N ) : pK a = 9, 2 . + Potentiel standard à pH = 0 : E° ( A g / Ag ) = 0, 80 V ; E° ( Zn E° ( O 2 gaz / H 2 O ) = 1, 23 V . 2+ / Zn ) = 0, 76 V ; On note la constante globale de formation du complexe Ag ( CN ) 2 : log = 21, 0 . 2 On note la constante globale de formation du complexe Zn ( CN ) 4 : log = 16, 8 . Partie II - Synthèse partielle du cholestérol Les structures des composés intervenant dans la synthèse sont regroupées en annexe. II.A - Le cholestérol Le cholestérol est un stéroïde dont la formule plane est donnée ci-contre (les lettres A , B , C et D désignent les différents cycles). C'est un composé C D intermédiaire dans la biosynthèse de A B tous les stéroïdes du corps humain. Cholestérol Un seul des stéréoisomères correspon- HO dant à cette formule plane est le cholestérol. On propose ici une synthèse partielle de ce composé. Concours Centrale-Supélec 2008 6/10 CHIMIE II.A.1) II.A.2) Filière PC Combien d'atomes de carbone asymétriques présente le cholestérol ? À combien de stéréoisomères correspond cette formule plane ? II.B - Étude d'une réaction de Diels-Alder A réagit avec B , le buta-1,3-diène, pour donner C . Des données relatives aux orbitales frontières des composés A et B sont regroupées ci-dessous (voir numérotation des atomes en annexe). Chaque groupe méthyle est assimilé à un hétéroatome à une orbitale et à deux électrons. Notation : HO ( A ) représente l'orbitale moléculaire (O. M.) la plus haute occupée de A . BV ( A ) représente l'orbitale moléculaire (O. M.) la plus basse vacante de A . Énergies O. M. Expression des orbitales moléculaires : coefficients successifs des orbitales atomiques i relativement à la numérotation des atomes donnée en annexe. + 0, 77 HO ( A ) ( 0, 01 ; 0, 40 ; 0, 58 ; 0, 05 ; 0, 33 ; 0, 43 ; 0, 03 ; 0, 21 ; 0, 19 ; 0, 33 ; 0, 15 ) + 0, 19 BV ( A ) ( 0, 37 ; 0, 32 ; 0, 18 ; 0, 36 ; 0, 33 ; 0, 20 ; 0, 46 ; 0, 44 ; 0, 13 ; 0, 16 ; 0, 05 ) + 0, 62 HO ( B ) ( 0, 60 ; 0, 37 ; 0, 37 ; 0, 60 ) 0, 62 BV ( B ) ( 0, 60 ; 0, 37 ; 0, 37 ; 0, 60 ) Les énergies associées aux orbitales moléculaires de l'éthylène valent + et . II.B.1) Les orbitales moléculaires de A étant indicées par énergie croissante, à quels indices correspondent la HO et la BV de A ? II.B.2) Identifier l'interaction HO BV prédominante lors de la réaction entre A et B . Dans des conditions identiques, quel réactif, de A ou de l'éthylène, réagit le plus vite avec B ? Justifier la réponse. II.B.3) C correspond-il à la régiosélectivité prévue par un contrôle frontalier ? Donner la formule plane de son isomère C également formé lors de la réaction entre A et B . II.B.4) Représenter, en justifiant, les deux stéréoisomères correspondant à C effectivement obtenus lors de cette réaction (on utilisera impérativement le même mode de représentation que celui utilisé pour D ). Par quelle relation d'isomérie sont-ils liés ? Concours Centrale-Supélec 2008 7/10 CHIMIE Filière PC II.B.5) Placé dans une solution méthanolique d'hydroxyde de potassium, l'un de ces stéréoisomères s'isomérise en D . Représenter ce stéréoisomère. Écrire le mécanisme de cette réaction. Indiquer sa force motrice en justifiant la réponse à l'aide d'une représentation de D dans laquelle les deux cycles sont en conformation chaise. Indiquer, en la justifiant, la configuration des centres asymétriques de D . Par la suite, seules les formules planes des composés seront considérées. II.C - Aménagement fonctionnel H 2 SO 4 , H 2 O NaBH 4 , NaOH E D éthanol, eau réduction par Zn F température ambiante G acide acétique, chauffage II.C.1) Représenter le composé E sachant que le tétrahydruroborate de sodium est utilisé en excès. Pour 1 mole de D , quelle quantité de NaBH 4 est effectivement consommée lors de la réaction ? II.C.2) Proposer un mécanisme pour la transformation de E en F . Le passage de F à G correspond à la réduction du groupe alcool -- CH ( OH ) -- en groupe méthylène -- CH 2 --. II.D - Formation du cycle B du stéroïde 1) quantité équimolaire G de LDA dans THF 2) pent-1-én-3-one I H ? J méthanol non K IO 4 L étudié II.D.1) LDA est le diisopropylamidure de lithium et THF le solvant tétrahydrofurane. Représenter l'anion obtenu à partir de G puis l'anion H obtenu par son addition 1, 4 sur la pent-1-én-3-one. L'ajout de méthanol permet une évolution de H en I ; écrire le mécanisme correspondant et indiquer en quoi le méthanol favorise cette évolution. II.D.2) Dans quelles conditions peut-on passer de I à J ? Le passage J K n'est pas étudié. II.D.3) Représenter L . II.E - Formation du cycle D du stéroïde L ? M 1) A g 2 O 2)méthanol, H 2 SO 4 léger chauffage N ? O II.E.1) Cyclisation intramoléculaire Proposer des conditions opératoires pour passer de L à M et nommer les réactions correspondantes. Représenter l'autre composé que l'on peut former dans ces conditions. Concours Centrale-Supélec 2008 8/10 CHIMIE Filière PC II.E.2) Oxydation et réduction sélectives a) L'oxyde d'argent est un oxydant doux permettant de passer d'un groupe aldéhyde à un groupe acide carboxylique. Représenter N . Peut-on utiliser le permanganate de potassium à la place de l'oxyde d'argent pour oxyder M ? b) Proposer, en justifiant, des conditions opératoires pour passer de N à O . II.F - Modification du squelette carboné O 1) NaBH 4, EtOH, NaOH + 2) H 3 O , H 2 O, 60° C 3)anhydride éthanoïque P 1) SOCl 2 Q ? R 2) Me 2 CuLi, Et 2 O, 78° C 3) hydrolyse prudente II.F.1) Quelles réactions observe-t-on lors des phases 1 , 2 et 3 permettant de passer de O à P ? Représenter P . Commenter le choix de l'hydrure utilisé lors de la phase 1 . Écrire le mécanisme de l'étape 3 en considérant le cas plus simple d'un alcool ROH . II.F.2) Chimiosélectivité de l'action du composé organométallique a) Quel groupe fonctionnel obtient-on après traitement de P par SOCl 2 ? Par quel type de réaction le diméthylcuprate de lithium réagirait-il sur P ? b) Justifier l'utilisation de SOCl 2 ainsi que le choix du réactif (cuprate lithié plutôt que magnésien) et de la température pour ce passage. c) En assimilant le cuprate à un carbanion méthyle, proposer un mécanisme pour l'obtention du groupe méthylcétone. d) Pourquoi faut-il une hydrolyse prudente ? Quelles conditions peut-on proposer pour cette hydrolyse ? II.F.3) Q est mis en présence d'une quantité identique d'un organomagnésien. Après hydrolyse acide, on isole R ne comportant que deux atomes d'oxygène. a) Représenter l'organomagnésien utilisé compte tenu de la structure du cholestérol et écrire la formule topologique de R . b) Imaginer un protocole opératoire pour récupérer R pur. c) Quel est l'intérêt de l'estérification lors du passage de M à N ? Quel est l'intérêt de l'acylation effectuée lors du passage de O à P ? Concours Centrale-Supélec 2008 9/10 CHIMIE Filière PC Annexe Structures de certains composés intermédiaires : 8 O 4 A 3 11 10 O 2 O B 9 5 2 1 6 C 3 4 MeO 1 O7 O O Me D F xx MeO I O O H OH O OH OH K J OH OH O O COOCH 3 O M O O O O Q O O ··· FIN ··· Concours Centrale-Supélec 2008 10/10