CCINP Chimie PC 2016
| Thème de l'épreuve | Étude du radical hydroxyle. Synthèse de l'oséltamivir. |
| Principaux outils utilisés | orbitales moléculaires, oxydoréduction, thermodynamique, cristallographie, chimie organique |
| Mots clefs | radical, hydroxyle, oséltamivir |
Corrigé
: 👈 gratuite pour tous les corrigés si tu crées un compte👈 l'accès aux indications de tous les corrigés ne coûte que 5 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)















Rapport du jury
(télécharger le PDF)




Énoncé obtenu par reconnaissance optique des caractères
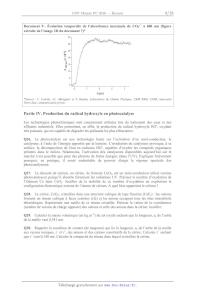
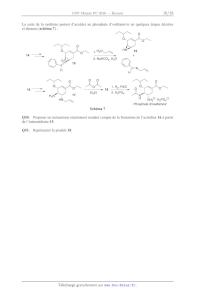
SESSION 2016 PCCH007 ! ! ! EPREUVE SPECIFIQUE - FILIERE PC! !!!!!!!!!!!!!!!!!!!!" ! CHIMIE Jeudi 5 mai : 14 h - 18 h! !!!!!!!!!!!!!!!!!!!!" N.B. : le candidat attachera la plus grande importance à la clarté, à la précision et à la concision de la rédaction. Si un candidat est amené à repérer ce qui peut lui sembler être une erreur d'énoncé, il le signalera sur sa copie et devra poursuivre sa composition en expliquant les raisons des initiatives qu'il a été amené à prendre.! ! !!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!" ! ! ! ! Les calculatrices sont autorisées ! ! ! ! ! Le sujet est composé de deux problèmes indépendants. ! - Le premier problème concerne une étude autour du radical hydroxyle : détection ! expérimentale, réactivité en milieu biologique, génération par radiolyse de leau, production ! par photocatalyse. ! Aucune connaissance particulière sur les espèces radicalaires nest nécessaire pour traiter ce ! problème. ! ! - Le deuxième problème traite de la synthèse industrielle du phosphate doséltamivir. ! ! Chaque problème est constitué de parties indépendantes. ! Toutes les données utiles sont disponibles à la fin de chaque problème. ! ! ! ! ! ! ! ! ! 1/18 ! PROBLÈME 1 Autour du radical hydroxyle Présentation générale Le radical hydroxyle, HO!, espèce transitoire de très courte durée de vie, constitue lune des espèces les plus étudiées en chimie radicalaire. Ce radical libre très réactif, électriquement neutre, peut être produit lors de la décomposition de peroxyde dhydrogène, HOOH, ou à partir de molécules deau irradiées (document 1). On le retrouve donc dans latmosphère, dans les milieux aqueux soumis aux rayonnements et même in vivo. Par ailleurs, le radical hydroxyle intervient dans divers procédés comme lors de la dépollution photocatalytique deffluents aqueux. Document 1 - Les espèces radicalaires et les processus homolytiques Il existe deux types de rupture de liaison covalente entre deux fragments A et B : - la rupture dite "hétérolytique" : les deux électrons de la liaison sont captés par lun des deux fragments. Cette rupture conduit alors à la formation dions : AB ! A+ + | B - la rupture dite "homolytique" : les deux électrons de la liaison sont répartis équitablement conduisant à deux espèces chimiques dites "radicalaires" : AB ! A! + B! Dans les notations A! et B!, le point « ! » représente lélectron célibataire porté par chaque radical. Les espèces radicalaires peuvent être électriquement neutres ou chargées. Etant donné que les liaisons chimiques ont des énergies de lordre de quelques centaines de kJ.mol1, les conditions mises en jeu pour former des radicaux sont souvent drastiques : hautes températures, radiations ionisantes, rayonnements ultraviolets. Partie I. Approche théorique et détection expérimentale du radical hydroxyle On désire construire le diagramme dénergie des orbitales moléculaires (OM) du radical hydroxyle, HO!, pour expliquer sa réactivité et prédire certaines de ses propriétés spectroscopiques. Q1. Écrire les configurations électroniques de latome doxygène et de latome dhydrogène dans leur état fondamental. Préciser les orbitales de valence des deux atomes ainsi que la valeur des nombres quantiques associés à ces orbitales. Q2. Représenter schématiquement ces orbitales de valence. Connaissant les énergies des orbitales atomiques (OA) des atomes H et O et en choisissant laxe y comme axe internucléaire, préciser les OA de valence à combiner pour construire les OM du radical HO!. Justifier. Q3. On trace le diagramme des OM de lentité diatomique HO! en combinant les orbitales de valence des atomes H et O (document 2, page 3). Reproduire ce diagramme sur la copie. Identifier la symétrie ! ou " de chacune des OM représentées sur le diagramme dénergie. Préciser le caractère liant, non-liant ou antiliant de chaque OM. Placer les électrons dans ce diagramme. Donner alors la configuration électronique de HO!. 2/18 Document 2 - Diagramme dorbitales moléculaires du radical HO! Q4. Le moment dipolaire de HO! a été évalué expérimentalement à 1,66 D (D correspondant au Debye, 1 D = 3,34 x 10-30 C.m). Commenter, à partir du diagramme dénergie, la polarité de la liaison HO. Déduire également de ce diagramme lequel des deux atomes est porteur de lélectron célibataire. Q5. Calculer lindice (lordre) de liaison de HO!. Ce radical est-il stable vis-à-vis de la dissociation des noyaux ? Q6. Écrire la structure de Lewis de HO!. Dans le cas de ce radical, le formalisme de Lewis est-il en accord avec les résultats obtenus dans le cadre de la théorie des OM ? Justifier. Q7. Des calculs de chimie quantique, de type TDDFT (Time-Dependent Density FunctionalTheory), effectués sur le radical HO! en phase gazeuse, ont permis dévaluer les énergies des transitions électroniques. Il a été montré que la transition de plus basse énergie (7,75 eV) permettait dexciter un électron vers la plus basse OM non occupée (BV). Daprès ces calculs, quelle serait la longueur donde dabsorption maximale de HO! en phase gazeuse ? À laide du diagramme dénergie complété à la question Q3, identifier, en la justifiant, cette transition électronique. Q8. La détection expérimentale du radical hydroxyle est difficile en phase gazeuse comme en phase condensée. Expliquer pourquoi lobservation dune espèce radicalaire est difficile. En solution aqueuse, il a été démontré, par spectrophotométrie dabsorption ultra-rapide (résolue en temps) que HO! possédait un maximum dabsorption à 234 nm. Dans le cas du radical hydroxyle, comment expliquer le décalage spectral observé entre la phase gazeuse et la phase aqueuse condensée ? 3/18 Q9. Des expériences de RPE (Résonance Paramagnétique Électronique) (document 3) réalisées à très basse température ont permis la détection des radicaux HO!. Expliquer brièvement pourquoi la RPE est une méthode adaptée à la détection des espèces radicalaires. Justifier de la nécessité de travailler à basse température. Document 3 - La spectroscopie RPE (Résonance Paramagnétique Électronique) La RPE utilise la propriété que possèdent certains électrons dabsorber puis de réémettre lénergie dun rayonnement électromagnétique lorsquils sont placés dans un champ magnétique. Cette propriété est analogue à celle des noyaux atomiques en RMN (Résonance Magnétique Nucléaire). La spectroscopie RPE, qui a été développée à partir du milieu du 20e siècle, constitue un puissant moyen de détection et de caractérisation des systèmes moléculaires paramagnétiques tels que les sels et les complexes de métaux de transition. Les informations fournies par la RPE concernent la structure électronique et géométrique des systèmes étudiés ainsi que leur comportement dynamique. Q10. Le radical hydroxyle, HO!, ainsi que le radical hydrosulfure (sulfanyle), HS!, ont été identifiés dans une grande variété denvironnements astrophysiques grâce à lobservation de leurs spectres électroniques et vibrationnels. Expliquer pourquoi ces deux radicaux possèdent des propriétés spectroscopiques similaires. Lexistence du radical HO! peut être prouvée grâce à lobservation de son mode de vibration à 3 570 cm1. Quelle technique de détection expérimentale est alors utilisée ? Partie II. Réactivité du radical hydroxyle en milieu biologique Le dioxygène, O2, composé indispensable aux organismes aérobies, subit in vivo une réduction tétravalente qui implique un échange global de quatre électrons et qui conduit à la formation deau. En réalité, ces quatre électrons ne sont pas échangés simultanément, mais lors de quatre étapes monoélectroniques successives : - réduction de O2 en anion radical superoxyde, O2! ; (i) ! - réduction de O2 en peroxyde dhydrogène, H2O2 ; (ii) ! - réduction de H2O2 en eau, H2O, avec production de radical hydroxyle, HO ; (iii) (iv) - réduction de HO! en eau, H2O. La métabolisation de O2 fait donc intervenir des espèces radicalaires très réactives : les radicaux hydroxyle et superoxyde, tout comme dailleurs leurs espèces acido-basiques conjuguées. Q11. Écrire les quatre demi-équations électroniques (étapes (i) à (iv)) dans le sens de la réduction. En déduire la demi-équation de réduction globale (réaction (v)) impliquant le couple redox O2/H2O. On veillera à équilibrer lensemble des demi-équations redox à laide des ions H+ et des molécules H2O. Q12. Le potentiel redox standard, E°, est une grandeur qui caractérise tout couple redox. Quel pouvoir E° permet-il de quantifier ? Est-ce une grandeur thermodynamique intensive ou extensive ? Justifier en rappelant la définition de telles grandeurs. 4/18 Q13. En milieu biologique, les couples redox sont caractérisés par leurs potentiels standard apparents à pH = 7 (potentiels standard biologiques, notés E°, document 4). Déterminer lexpression du potentiel standard biologique E°v du couple O2/H2O en fonction des potentiels standard biologiques (E°i à E°iv) des couples redox intervenant dans les réductions (i) à (iv). Calculer sa valeur à 298 K. Document 4 - Potentiel standard apparent et potentiel standard biologique Pour tout couple redox Ox/Red dont la demi-équation électronique fait intervenir des ions H+, on définit un potentiel standard apparent E°pH = f (E°, pH) qui traduit la variation du potentiel E avec le pH lorsque tous les constituants, autres que H+, ont une activité unité. À pH = 7, le potentiel standard apparent, noté alors E°, est appelé potentiel standard biologique. Q14. Le radical HO! peut réagir sur lui-même à pH = 7 dans une réaction de dimérisation (« dismutation ») à 298 K. Écrire léquation de cette réaction de dimérisation. Exprimer puis calculer à 298 K, la constante déquilibre, K° (définie à pH = 7), de cette réaction de dimérisation. La réaction est-elle quantitative ? Proposer une interprétation à partir de la structure électronique des espèces mises en jeu. Q15. Exprimer à 298 K, selon la loi de Nernst, le potentiel redox, Eiv, du couple HO!/H2O en fonction des concentrations. En déduire lexpression du potentiel standard apparent E°iv,pH en fonction du pH, puis la valeur du potentiel standard E°iv. Q16. En milieu alcalin, HO! est transformé en sa base conjuguée O!. Écrire, dans le sens de la dissociation de lacide, la réaction caractéristique du couple acido-basique HO!/O! en solution aqueuse. Justifier quantitativement quil est raisonnable de négliger in vivo, à 298 K et à pH = 7, la présence de O!. Q17. Le radical superoxyde, O2!, est impliqué in vivo dans des réactions relativement lentes. Sa nocivité est, en fait, attribuée à son acide conjugué HO2!. Écrire, dans le sens de la dissociation de lacide, la réaction caractéristique du couple acido-basique HO2!/O2!. Calculer, à 298 K, lenthalpie libre standard de cette réaction, !rG°. Retrouver, à cette température, la valeur du pKa du couple HO2!/O2!. Q18. On suppose que lenthalpie standard de réaction,"!rH°, ainsi que lentropie standard de réaction,"!rS°, associées à la dissociation de lacide HO2!, ne varient pas avec la température dans la gamme des températures considérées. Calculer !rS°, à 298 K, sachant quà cette même température !rH° = 454,20 kJ.mol1. Commenter le signe de !rS°. Q19. Écrire, dans le sens de la réduction, la demi-équation redox associée au couple HO2!/H2O2 (réaction (vi)). Exprimer, à 298 K, le potentiel standard E°vi du couple HO2!/H2O2 en fonction du potentiel standard E°ii du couple O2!/H2O2 et du pKa du couple HO2!/O2!. En déduire, à 298 K, la valeur du potentiel standard E°vi sachant quà cette même température E°ii = 1,77 V. Q20. Exprimer, à 298 K, le potentiel standard apparent E°vi,pH du couple HO2!/H2O2 en fonction du pH. Calculer, à cette température, la valeur du potentiel standard biologique E°vi de ce couple. Montrer alors que le radical hydroxyle, HO!, demeure plus oxydant que les radicaux HO2! et O2! dans les conditions standard apparentes à pH = 7. 5/18 Partie III. Génération du radical hydroxyle par radiolyse de leau Un rayonnement ionisant est un rayonnement de forte énergie qui provoque lexcitation et lionisation (radiolyse) des molécules du milieu quil traverse. Ainsi, la pénétration de rayonnements ! issus dune source radioactive de 60Co ou dun faisceau délectrons issu dun accélérateur de particules induit, dans leau ou dans les solutions aqueuses diluées, la formation de + molécules deau excitées, H2O*, ou ionisées, H2O! , selon : H2O ! H2O* + H2O ! H2O! + e Q21. Le cobalt est un élément chimique qui existe à létat naturel sous la forme dun seul isotope stable : lisotope 59Co. Cependant, de nombreux isotopes radioactifs artificiels du cobalt existent, dont lisotope 60Co qui est caractérisé par une période radioactive, ou temps de demi-vie, T = 5,27 ans. Préciser la différence qui existe entre les noyaux du 59Co et du 60Co. Sachant quune décroissance radioactive est un processus qui suit une cinétique de premier ordre, calculer la constante de vitesse de désintégration du 60Co. Q22. Une microseconde après le passage dun rayonnement ionisant dans une solution aqueuse diluée aérée (présence de dioxygène dissous), on observe, dans le milieu irradié, la distribution homogène des espèces radiolytiques suivantes : HO!, H!, H2O2, H2 et HO2!. En vous aidant du document 1, page 2, proposer des processus (réactions) simples permettant dexpliquer la formation de lensemble de ces espèces radicalaires et moléculaires. Q23. En radiolyse impulsionnelle (document 5), les espèces radiolytiques générées en solution aqueuse sont détectées au moyen de diverses techniques rapides. Expliquer pourquoi il nest pas possible de détecter les radicaux HO! (produits par radiolyse impulsionnelle) à laide dune StreakCamera de type Hamamatsu C7700 (document 6). Document 5 - La radiolyse impulsionnelle et la détection des radicaux hydroxyle En radiolyse impulsionnelle, un faisceau délectrons pulsé irradie en quelques nanosecondes, voire en quelques picosecondes, une solution aqueuse et génère dans le milieu les espèces radiolytiques. Ces espèces sont alors détectées au moyen de diverses techniques résolues en temps. Cest, par exemple, par spectrophotométrie dabsorption résolue en temps, à laide dun oscilloscope rapide, que lon a détecté le radical hydroxyle et démontré quil absorbait à 234 nm. Document 6 - La Streak-Camera comme système de détection en radiolyse impulsionnelle Depuis les années 1960 et les premières expériences de radiolyse impulsionnelle, les systèmes de détection nont cessé dêtre améliorés. Grâce à leur très haute résolution temporelle, les caméras à balayage de fente (Streak-Cameras) sont utilisées pour suivre les phénomènes optiques ultrarapides. En plus de leur haute résolution temporelle, ce sont les seuls détecteurs optiques permettant de capturer à la fois la forme temporelle et spectrale des signaux. Elles sont actuellement utilisées pour suivre lévolution temporelle de labsorbance despèces transitoires formées par radiolyse impulsionnelle à léchelle de la picoseconde. Le modèle C7700 de Streak-Camera, construit par Hamamatsu, possède les caractéristiques suivantes : - domaine de temps : de 500 ps à 1 ms ; - résolution temporelle : 3,7 ps ; - domaine spectral : de 250 nm à 850 nm ; - résolution en longueur donde : 1 nm ; - résolution en absorbance : 0,5 %. 6/18 Q24. Les radicaux HO!, produits par radiolyse impulsionnelle en solution aqueuse, sont connus pour réagir quantitativement avec les ions carbonate, CO32, générant dans le milieu des radicaux anions CO3!. Écrire léquation de réaction correspondante. Q25. Les radicaux CO3!, formés par radiolyse impulsionnelle à partir du radical HO!, peuvent être détectés et leur réactivité peut être suivie grâce à la Streak-Camera C7700 (documents 7, 8 et 9, page 8). Sur le profil cinétique du document 9, la montée de labsorbance de CO3! à 600 nm nest pas immédiate après le pulse délectrons et ce, malgré le temps de réponse rapide de la StreakCamera. Expliquer pourquoi. Tracer (sans justification) lallure du spectre dabsorption du radical CO3! enregistré 2 "s après le pulse délectrons en y précisant la valeur de labsorbance maximale ainsi que celle de la longueur donde dabsorption maximale. Document 7 - Image 2D obtenue par Streak-Camera de lévolution temporelle du spectre dabsorption du radical CO3! dans leau* *Source : C. Coletta, J.L. Marignier et S. Remita, Laboratoire de Chimie Physique, UMR 8000, CNRS, université Paris-Sud, communication privée. Document 8 - Les signaux obtenus par la Streak-Camera Lors dune acquisition, les résultats collectés par une Streak-Camera sont sous forme dune image 2D de résolution 1 024 × 1 344 pixels. Limage correspond alors à labsorbance de la solution irradiée en fonction de la longueur donde (axe des abscisses) et du temps (axe des ordonnées). Les différents niveaux de gris de limage correspondent aux différentes valeurs de labsorbance. Les pixels les plus foncés correspondent aux absorbances les plus élevées. La Streak-Camera permet ainsi dobtenir sur une seule image, en une seule acquisition, la cinétique aux différentes longueurs donde et le spectre dabsorption à différents temps après le pulse délectrons. 7/18 Document 9 - Évolution temporelle de labsorbance maximale de CO3! à 600 nm (figure extraite de limage 2D du document 7)* *Source : C. Coletta, J.L. Marignier et S. Remita, Laboratoire de Chimie Physique, UMR 8000, CNRS, université Paris-Sud, communication privée. Partie IV. Production du radical hydroxyle en photocatalyse Les technologies photochimiques sont couramment utilisées lors du traitement des eaux et des effluents industriels. Elles permettent, en effet, la production du radical hydroxyle HO!, oxydant très puissant, qui est capable de dégrader les polluants les plus réfractaires. Q26. La photocatalyse est une technologie basée sur lactivation dun semi-conducteur, le catalyseur, à laide de lénergie apportée par la lumière. Lirradiation du catalyseur provoque, à sa surface, la décomposition de l'eau en radicaux HO!, capables doxyder les composés organiques présents dans le milieu. Néanmoins, lactivation des catalyseurs disponibles aujourdhui sur le marché nest possible que pour des photons de fortes énergies (dans lUV). Expliquer brièvement pourquoi, en pratique, il serait souhaitable de pouvoir élargir la réponse spectrale des photocatalyseurs. Q27. Le dioxyde de cérium, ou cérine, de formule CeO2, est un semi-conducteur utilisé comme photocatalyseur puisquil absorbe fortement les radiations UV. Préciser le nombre doxydation de lélément Ce dans CeO2. Justifier de la stabilité de ce nombre doxydation en explicitant la configuration électronique externe de latome de cérium. À quel bloc appartient le cérium ? Q28. La cérine, CeO2, cristallise dans une structure cubique de type fluorine (CaF2) : les cations forment un réseau cubique à faces centrées (cfc) et les anions occupent tous les sites interstitiels tétraédriques. Représenter une maille de ce réseau cristallin. Préciser la valeur de la coordinence (nombre de voisins de charge opposée) des cations et celle des anions dans la cérine. Justifier. Q29. Calculer la masse volumique (en kg.m3) de cet oxyde sachant que la longueur, a, de larête de la maille vaut 0,541 nm. Q30. Rappeler la condition de contact (de tangence) qui lie la longueur, a, de larête de la maille aux rayons ioniques, r et r+, des anions et des cations constitutifs de la cérine. Calculer r+ sachant que r vaut 0,140 nm. Calculer la compacité du réseau dans lequel cristallise la cérine. 8/18 Données du Problème 1 Numéros atomiques Z : Élément H O S Co Ce Z 1 8 16 27 58 Énergies des orbitales atomiques (OA) des éléments H et O, données en eV : 1s H O 13,6 538,0 2s 32,4 2p 15,9 Potentiels standard biologiques (E°pH à pH = 7), notés E°, donnés en volts (V) à 298 K par rapport à lélectrode standard à hydrogène, ESH : Réaction (i) (ii) (iii) (iv) (v) (vi) Couple redox O2/O2! O2!/H2O2 H2O2/H2O, HO! HO!/H2O O2/H2O HO2!/H2O2 E° (V) 0,33 0,93 0,30 2,34 pKa à 298 K : HO!/O! HO2!/O2! pKa 11,9 4,7 Enthalpies libres standard de formation en solution aqueuse, !fG° (kJ.mol1), à 298 K : !fG° (kJ.mol1) H+ O2! HO2! 0 31,77 5,02 Masses molaires atomiques M (g.mol1) : Élément O Ce M (g.mol1) 16,0 140,1 Constante de Planck : h = 6,62 × 1034 J.s Célérité de la lumière : c = 3 × 108 m.s1 Constante détat des gaz parfaits : R = 8,31 J.K1.mol1 Constante de Faraday : F = 96 485 C.mol1 Nombre dAvogadro : NA = 6,02 × 1023 mol1 2,3 × RT/F = 0,06 V pour T = 298 K 1 eV = 1,6 × 1019 J 9/18 PROBLÈME 2 Synthèse de loséltamivir Pour lécriture des mécanismes, chaque fois quil le juge nécessaire, le candidat pourra utiliser des notations simplifiées des molécules lui permettant de ne se concentrer que sur les groupes caractéristiques concernés. Présentation générale Loséltamivir est un médicament antiviral utilisé pour le traitement et la prévention des grippes A et B. Il est distribué sous la marque Tamiflu® sous la forme dun phosphate, le phosphate doséltamivir. Jusquen 2005, celui-ci était produit industriellement à partir de lacide shikimique extrait de la badiane chinoise (Illicium verum), aussi appelée anis étoilé, cultivée dans le sud de la Chine entre Shanghai et la frontière vietnamienne. Depuis, d'autres plantes comme le liquidambar ou le ginkgo se sont révélées être des sources potentielles d'acide shikimique. Le sujet proposé sintéresse à la synthèse industrielle du phosphate doséltamivir obtenu en 13 étapes à partir de lacide shikimique (schéma 1) : Schéma 1 Partie I. Synthèse industrielle du phosphate doséltamivir La synthèse industrielle de loséltamivir débute par la préparation du composé bicyclique 3 obtenu en 3 étapes à partir de lacide shikimique (schéma 2) : Schéma 2 Q31. Lacide shikimique est un composé chiral. Justifier cette affirmation et représenter son énantiomère. Q32. Identifier et nommer les groupes caractéristiques présents dans lacide shikimique. Q33. Le spectre infrarouge (IR) de lacide shikimique est représenté dans le document 10, page 11. Pour les deux bandes dabsorption indiquées par les flèches ! et " sur le document 10, proposer une attribution. 10/18 Document 10 - Spectre infrarouge (IR) de lacide shikimique (! en cm1)* *Source : Spectral Database for Organic Compounds, SDBSWeb : http://sdbs.db.aist.go.jp (National Institute of Advanced Industrial Science and Technology, Japan, 2015) Q34. Dans le chlorure de thionyle, SOCl2, latome de soufre central est lié aux deux atomes de chlore et à latome doxygène. Donner le schéma de Lewis de SOCl2. Quelle géométrie peut être déduite de la méthode VSEPR pour cette molécule ? Indiquer la valeur théorique des angles de liaison. La molécule de chlorure de thionyle est-elle polaire ? Justifier les réponses. Q35. Représenter les composés 1 et 2. Q36. Quelle fonction est créée lors la formation du produit 3 à partir de lintermédiaire 2 ? Proposer des conditions expérimentales permettant deffectuer cette transformation. Le composé 3 est ensuite transformé en azoture 8 à laide de la séquence réactionnelle ci-dessous (schéma 3) : Schéma 3 Q37. Le mésylate 4 est obtenu par réaction de lalcool 3 avec le chlorure de mésyle, CH3SO2Cl, en présence de triéthylamine, Et3N. Proposer une équation de réaction permettant de modéliser cette transformation et le rôle de la triéthylamine, que lon explicitera. 11/18 Le composé 5 est traité en milieu basique pour donner lintermédiaire 6. Celui-ci évolue spontanément en un produit bicyclique 7 de formule brute C14H22O4 obtenu sous la forme dun seul stéréoisomère. Q38. Représenter lintermédiaire 6. À laide de la table des valeurs de pKa (page 17) proposer la formule dune base qui permettrait de former sélectivement lintermédiaire 6 à partir du composé 5 en justifiant la réponse. Q39. Justifier lintérêt de la formation du mésylate 4 à partir de lalcool 3. À laide du document 11, indiquer quel(s) autre(s) réactif(s) aurai(en)t pu être a priori utilisé(s) à la place du chlorure de mésyle, CH3SO2Cl. Justifier la réponse et proposer une interprétation du choix fait en faveur du chlorure de mésyle. Document 11 - La substitution nucléophile En chimie organique, une substitution nucléophile (SN) est une réaction au cours de laquelle un nucléophile (Nu) remplace un nucléofuge dans une molécule. Le nucléofuge, encore appelé groupe partant (GP), est très souvent un anion : Nu + RGP ! RNu+ + GP Un nucléofuge est caractérisé par sa labilité, cest-à-dire sa capacité à pouvoir se détacher plus ou moins facilement de la molécule. La labilité du nucléofuge est corrélée à la stabilité de celui-ci. Elle est inversement proportionnelle à la force du nucléofuge en tant que base, un bon nucléofuge correspondant toujours à la base conjuguée dun acide fort. Lorsque le nucléofuge est porté par un centre stéréogène, sa labilité joue un rôle déterminant dans la stéréosélectivité de la substitution nucléophile. Une trop grande labilité de celui-ci peut en effet conduire à la perte de linformation stéréochimique sur le centre stéréogène, en particulier quand un carbocation secondaire ou tertiaire peut être formé. Q40. Représenter le composé 7 de formule brute C14H22O4. Justifier la stéréosélectivité de sa formation. Le composé bicyclique 7 est ensuite traité par lazoture de sodium, NaN3, pour donner le produit majoritaire 8 accompagné dun isomère 8bis. Q41. Donner les trois structures limites de résonance de lion azoture, N3, respectant la règle de loctet pour tous les atomes. Quelle est la structure limite de résonance la plus contributive à la forme réelle ? Justifier la réponse. Q42. Représenter lisomère 8bis. La suite de la synthèse de loséltamivir fait intervenir une réaction de Staudinger (document 12, page 13) sur lazoture 8. Mis en réaction avec la triphénylphosphine dans des conditions strictement anhydres, lazoture 8 conduit ainsi à un intermédiaire 9 instable qui se réarrange rapidement en aziridine 10 (schéma 4) : Schéma 4 12/18 Q43. À laide du document 12, proposer une structure pour lintermédiaire 9. Document 12 - La réaction de Staudinger La réaction de Staudinger permet de transformer un azoture en lamine correspondante dans des conditions douces compatibles avec de nombreuses fonctions. Deux étapes sont nécessaires : La première étape correspond à laddition nucléophile de la triphénylphosphine, P(C6H5)3, sur lazoture, conduisant à la formation dun iminophosphorane : Dans la deuxième étape, la réaction dhydrolyse de liminophosphorane conduit à lamine souhaitée. Loxyde de triphénylphosphine est en plus obtenu comme sous-produit. Cette étape se déroule selon le mécanisme suivant : Q44. Linstabilité de lintermédiaire 9 est due à la présence du groupement hydroxyle sur la molécule. Ce groupement joue le même rôle que celui de leau dans la réaction de Staudinger. Proposer un mécanisme réactionnel rendant compte de la formation de laziridine 10 à partir de lintermédiaire 9. Loséltamivir est finalement obtenu sous forme de phosphate en plusieurs étapes à partir de laziridine 10 (schéma 5) : Schéma 5 Q45. Représenter le composé 11 qui, traité par lacide phosphorique, H3PO4, donne directement loséltamivir sous forme de phosphate. 13/18 Q46. À laide du document 13, donner une raison pour laquelle lutilisation de lammoniac NH3 nest pas envisageable pour obtenir sélectivement le composé 11 à partir de laziridine 10. Proposer une séquence réactionnelle permettant deffectuer cette transformation en représentant les produits intermédiaires. Document 13 - Synthèse des amines primaires Les amines primaires (RNH2) peuvent être créées par la substitution nucléophile (SN) dun groupe nucléofuge, porté par un atome de carbone, à laide de l'ammoniac NH3. Cette méthode de préparation des amines primaires est cependant très peu utilisée en synthèse. Lamine primaire ainsi formée est en effet plus réactive que lammoniac de départ. Cette stratégie conduit donc inévitablement à des mélanges damines primaires (RNH2), secondaires (R2NH) et tertiaires (R3N) par polyalkylation de latome dazote. Cela en limite considérablement lintérêt en synthèse organique. Des méthodes alternatives de préparation des amines primaires utilisant des équivalents masqués du groupement NH2 sont ainsi généralement préférées. Ces méthodes comportent plusieurs étapes : o dans la 1re étape, un groupe nucléofuge porté par un atome de carbone est substitué par un nucléophile azoté via une réaction de type SN2 ou SN1 ; o une 2e étape, faisant appel à des réactions classiques de la chimie organique, est ensuite nécessaire pour obtenir le groupe NH2. Le tableau ci-dessous présente quelques méthodes couramment utilisées pour la synthèse des amines primaires (les éventuelles étapes dhydrolyse ne sont pas indiquées) : 1re étape 2e étape N3 (SN2) LiAlH4 N3 (SN2) H2, Pd/C N3 (SN2) PPh3 C6H5SO2NH (SN2) Na, NH3 CN (SN2) LiAlH4 CN (SN2) H2, Ni (SN2) KOH, H2O NO2 (SN2) LiAlH4 H2, Ni NO2 (SN2) Fe, CH3CO2H NH2CONH2 (SN1) KOH, H2O NO2 (SN2) 14/18 Q47. Le spectre de résonance magnétique nucléaire du proton (RMN 1H) du phosphate doséltamivir obtenu à 400 MHz dans le chloroforme deutéré (CDCl3) présente, entre autres, un signal doublet dintégration 1H et de constante de couplage 3J = 2,1 Hz au déplacement chimique !"="#$%&"ppm (partie par million). Attribuer ce signal à un ou des atomes dhydrogène caractéristique(s) du phosphate doséltamivir. Justifier la multiplicité. Partie II. Modification de Karpf et Trussardi Une modification de la synthèse industrielle de loséltamivir, développée en 2001 par Karpf et Trussardi, permet déviter lemploi dazotures souvent dangereux à manipuler. Limine 14 est tout dabord préparée à partir de lintermédiaire 7 (schéma 6) : Schéma 6 Q48. À laide du document 14, proposer un réactif 13 permettant dobtenir limine 14 à partir de lamine 12. Rappeler brièvement le principe de la distillation hétéroazéotropique dans le cas de la formation de limine 14. Quel est le rôle de cette technique dans cette transformation ? Document 14 - Formation des imines Les imines sont des analogues azotés des aldéhydes et des cétones. Ces composés, possédant une double liaison carboneazote, sont classiquement obtenus par réaction de condensation des aldéhydes et des cétones avec des amines primaires. Cette condensation équilibrée est généralement conduite en présence dune quantité catalytique dacide, la vitesse de la réaction passant par un maximum pour un pH voisin de 4 5 : Q49. Déterminer la configuration de la double liaison carboneazote de limine 14 (de même type que la double liaison carbonecarbone). Justifier la réponse. 15/18 La suite de la synthèse permet daccéder au phosphate doséltamivir en quelques étapes décrites ci-dessous (schéma 7) : Schéma 7 Q50. Proposer un mécanisme réactionnel rendant compte de la formation de laziridine 16 à partir de lintermédiaire 15. Q51. Représenter le produit 18. 16/18 Données du Problème 2 Numéros atomiques Z : Élément N O S Cl Z 7 8 16 17 N O S Électronégativités !"sur léchelle de Pauling : Élément Cl Électronégativité ! 3,0 3,4 2,6 3,2 Valeurs de pKa (à 25 °C par rapport à leau) de quelques couples acide-base* : Couple acide-base CH3(CH2)2CH3 / CH3(CH2)2CH2 pKa 49,0 36,0 [(CH3)2CH]2NH / [(CH3)2CH]2N CH3OH / CH3O 15,5 Et3NH+ / Et3N 10,8 HCO3 / CO32 10,3 NH4+ / NH3 9,2 CH3CO2H / CH3CO2 4,8 HF / F 3,2 CH3SO3H / CH3SO3 2,6 CH3C6H4SO3H / CH3C6H4SO3 6,5 HCl / Cl 8,0 HBr / Br 9,0 CF3SO3H / CF3SO3 14,0 *Sources : D. A. Evans, Harvard University (http://ccc.chem.pitt.edu/wipf/MechOMs/evans_pKa_table.pdf) ; Reactions, Mechanisms, and structure in Advanced Organic Chemistry 4th Edition, J. March ; John Wiley & Sons, Inc. ; 1992. 17/18 IR (gamme de nombres donde)* : Groupe fonctionnel !"(cm1) Intensité" OH acide 2 500 3 300 Intense et large C=O ester saturé 1 735 1 750 Intense C=O ester conjugué 1 715 1 730 Intense C=O cétone saturée 1 705 1 725 Intense C=O aldéhyde saturé 1 700 1 710 Intense C=O acide saturé 1 700 1 725 Intense C=O acide conjugué 1 690 1 715 Intense C=O cétone conjuguée 1 685 1 705 Intense C=O aldéhyde conjugué 1 680 1 690 Intense C=C alcène 1 640 1 690 Moyenne C=C alcène conjugué 1 635 1 650 Moyenne RMN 1H (gamme de déplacements chimiques)* : Protons # (ppm) CHCH=CH 1,5 2,4 2,3 2,8 CHN 3,5 4,2 CHO 3,5 4,2 RCO2CH 3,5 4,5 RCH=CHR 4,6 7,0 7,2 7,9 9,1 10,3 *Source : Tables of Spectral Data for Structure Determination of Organic Compounds 2nd Edition, E. Pretsch, W. Simon, J. Seibl, T. Clerc, W. Fresenius, J. F. K Hubert, E. Pungor, G. A. Rechnitz, W. Simon Eds. ; 1989. FIN 18/18