CCINP Chimie 1 PC 2009
| Thème de l'épreuve | Étude du soufre et de ses applications |
| Principaux outils utilisés | atomistique, cristallographie, thermochimie, chimie des solutions, diagramme binaire, synthèse organique |
| Mots clefs | soufre, pseudoptérosine, ZnS, binaire H2SO4 et SO3, solubilité de SO2, spectres RMN et IR, SN, Wittig, hydrogénation catalytique |
Corrigé
: 👈 gratuite pour tous les corrigés si tu crées un compte👈 l'accès aux indications de tous les corrigés ne coûte que 5 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)









Rapport du jury
(télécharger le PDF)
Énoncé obtenu par reconnaissance optique des caractères
av.--:o: @ " mm.--fifi
.... H...-->HOEO
o.... ËmfiE - m=oE...oaä ËËÈ
......=a_z=V...-->dcoe ...::OEc--Qu ...oe=ouzau
'
A
SESSION2°°9 concouas communs ronncnmouæs
PCCH 1 07
EPREUVE SPECIFIQUE - FILIERE PC
CHIMIE 1
Durée : 4 heures
Les calculatrices sont autorisées
NB. Le candidat attachera la plus grande importance à la clarté, à la précision
et à la concision
de la rédaction. Si un candidat est amené à repérer ce qui peut lui sembler
être une erreur
d 'énoncé, il le signalera sur sa copie et devra poursuivre sa composition en
expliquant les raisons
des initiatives prises. Toute réponse devra être clairement justifiée.
Dans chaque partie, de nombreuses questions sont indépendantes.
Toutes les données utiles au problème sont regroupées en fin de sujet.
On trouve dans la biomasse marine des molécules uniques qu'on ne trouve pas
dans la biomasse
terrestre animale ou végétale. Le secteur des biotechnologies marines connaît
une évolution rapide
au niveau mondial. La demande en biomolécules est en croissance (24 % par an),
en particulier dans
les segments pharmaceutiques, nutritionnels et cosmétiques. Les biomolécules
marines sont
utilisées pour leurs propriétés texturantes, antimicrobiennes, antioxydantes ou
antitumorales.
Ainsi, un extrait de corail, la pseudoptérostne C, est utilisé dans des savons,
gels ou crèmes pour la
peau pour ses propriétés anti-inflammatoires et analgésiques. Les différentes
pseudoptérosines se
distinguent, entre autre, par la structure du sucre, par la position de ce
dernier sur le noyau
aromatique. Certaines de ces structures (pseudoptérosine A-D) sont représentées
ci--dessous :
M_e
? t_:l 1 R1 R2 R3
' A H H H
B Ac H H Ac = CHsCO
C H Ac H
D H H Ac
Pseudoptérosine 1
Nous étudierons, dans la deuxième partie de cette épreuve, quelques aspects de
la chimie
développée autour de la synthèse de molécules de la famille des
pseudoptérostnes et plus
particulièrement de la pseudoptérosine A.
1/14
1- Etude de quelques propriétés du soufre
Nous étudions dans cette première partie quelques propriétés physico-chimiques
de l'élément soufre
et de ses oxydes.
1.1
1.2
1.3
Atomistique
1.1.1 Rappeler précisément chacune des règles permettant d'établir la
configuration
électronique d'un atome dans son état fondamental.
1.1.2 Donner la configuration électronique des atomes de phosphore et de soufre
dans leur
état fondamental. En déduire leur nombre d'électrons de valence.
1.1.3 Préciser les valeurs des nombres d'oxydation extrêmes du soufre. Quel
anion peut
former l'élément soufre ?
On mesure les énergies de première ionisation du phosphore et du soufre :
Energie de première ionisation 1012 kJ.mol' 1000 kJ.mol'
1.2.1 Définir l'énergie de première ionisation en précisant les états physiques
des espèces
mises en jeu.
1.2.2 Exprimer, sur l'exemple du soufre, l'énergie de première ionisation en
fonction des
énergies, ans np , des différentes orbitales atomiques de l'atome et de son ion.
1.2.3 Calculer, à l'aide des constantes de Slater, les valeurs des charges
nucléaires
effectives, perçues par les électrons de valence du soufre et du phosphore
ainsi que
celles de leurs ions, nécessaires au calcul de l'énergie de première ionisation
de ces
atomes.
1.2.4 En déduire les valeurs des énergies de première ionisation, en eV et en
kJ.mol°', du
phosphore et du soufre. Comparer aux valeurs expérimentales et commenter vos
résultats.
Le soufre cristallise avec le zinc dans la structure de type blende ZnS de
paramètre de maille
noté a.
1.3.1 Représenter, sur trois schémas distincts, les centres des ions
effectivement présents,
en se limitant à une seule maille du réseau :
-- sur un plan correspondant à une face du cube
- sur un plan parallèle à une face du cube et passant par le milieu du cube
- sur un plan contenant deux arêtes parallèles et n'appartenant pas à une même
face du cube.
1.3.2 Calculer le nombre de motifs de la maille conventionnelle ainsi que la
coordinence
cation--anion de la blende ZnS.
1.3.3 Etablir l'expression du paramètre de maille a en fonction des rayons des
ions
constituant la blende ZnS.
1.3.4 Sachant que la densité de la blende ZnS est de 4,1, calculer une valeur
du paramètre
de maille a.
2/14
1.3.5 Calculer, à l'aide des rayons ioniques puis covalents de Zn et S, deux
valeurs du
paramètre de maille a. Comparer ces deux valeurs à celle précédemment calculée.
Que dire du caractère de la liaison ZnS de la blende '?
1.4 Solubilité du dioxyde de soufre dans l'eau
On étudie l'équilibre (1) de solubilisation dans l'eau du dioxyde de soufre
gazeux, supposé parfait.
On considère, dans cette question, que la seule espèce présente dans l'eau est
le dioxyde de soufre
hydraté, noté SOz(aq), supposé infiniment dilué :
SOz(g) " SOz(âQ) (1)
T
ÔHA,GP
ôP
1.4.1 Rappeler l'expression de en fonction de la pression P et de la
T
température T, uLGP représentant le potentiel chimique du constituant A gaz
parfait
pur.
1.4.2 En déduire l'expression du potentiel chimique d'un constituant A gaz
parfait pur,
112,61), à la température T sous la pression P. Tous les termes de cette
expression
devront être soigneusement définis.
1.4.3 Rappeler l'expression du potentiel chimique d'un constituant A gaz
parfait en
mélange, à la température T et sous la pression P, en fonction de la pression
partielle
en A, PA, ainsi que l'expression de ce même potentiel chimique en fonction de la
fraction molaire en A, y A .
1.4.4 Exprimer le potentiel chimique d'un constituant A soluté supposé
infiniment dilué,
uAsol, à la température T et sous la pression P, dans l'échelle des
concentrations
molaires volumiques. Tous les termes de cette expression devront être
soigneusement définis.
1.4.5 En déduire une expression approchée de ce même potentiel chimique pour une
pression voisine de la pression standard P°. Justifier l'approximation.
1.4.6 Préciser la relation entre les potentiels chimiques lorsque l'équilibre
(l) est établi à la
température T et sous une pression totale fixée à 1 bar.
1.4.7 En déduire, lorsque l'équilibre (l) est établi à la température T et sous
une pression
totale fixée à 1 bar, une relation entre la concentration molaire volumique en
dioxyde
de soufre hydraté, Cso, , et la pression partielle en dioxyde de soufre gazeux,
PSO2 .
1.4.8 A partir de la relation précédente, exprimer une constante, notée kso, ,
ne dépendant
, - - , ' -1 -1
que de la temperature T et drmens1onnee a des mol.L .bar . Comment se nomme
cette constante ?
On mesure, à 298 K et sous 1 bar, une constante : k302 = 1,2 mol.L'l.bar"l.
1.4.9 Calculer la valeur de la concentration molaire volumique en dioxyde de
soufre
hydraté, c802 , à 298 K et sous 1 bar, en équilibre avec une atmosphère dont la
pression partielle en dioxyde de soufre gazeux est fixée à 1,0.10'8 bar.
3/14
1.5 Etude de la solubilité « totale >> du dioxyde de soufre dans l'eau
Le dioxyde de soufre a un comportement de diacide dans l'eau. On considère,
dans cette question,
que les espèces contenant l'élément soufre présentes en solution aqueuse sont :
SOz(aq), HSOQ(aq) et SOâ"(aq).
La température est fixée à 298 K et la pression totale est maintenue à 1 bar.
1.5.1 Représenter le diagramme de prédominance des différentes espèces en
solution
aqueuse en fonction du pH.
1.5.2 Exprimer la solubilité en solution aqueuse du dioxyde de soufre, s802 ,
en fonction
des concentrations molaires volumiques des différentes espèces en solution
aqueuse.
1.5.3 En déduire l'expression de la solubilité en solution aqueuse du dioxyde
de soufre,
5502 , en fonction de la pression partielle en dioxyde de soufre, P802 , de la
concentration en ions H3O+ et des constantes thermodynamiques nécessaires,
lorsque l'équilibre (l) est établi.
1.5.4 Quelle est, qualitativement, l'influence du pH sur la solubilité en
solution aqueuse
du dioxyde de soufre ? J ustifier simplement la réponse.
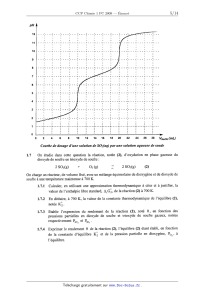
1.6 Dosage d'une solution aqueuse de dioxyde de soufre
On étudie le dosage de 10,0 mL d'une solution aqueuse de dioxyde de soufre, de
concentration
notée 0802 , par une solution aqueuse de soude, NaOH, de concentration 1,0.10'1
mol.L'l. On note
VNaoH le volume de soude versé. La courbe de pH a été modélisée et représentée
ci-après.
1.6.1 Ecrire les équations des réactions ayant lieu au cours du dosage.
Calculer les valeurs
de leur constante thermodynamique d'équilibre.
1.6.2 Pourquoi observe--t--on lors de ce dosage deux sauts de pH '? Calculer la
valeur de la
concentration en dioxyde de soufre 0802 .
1.6.3 Calculer les valeurs de pH pour les volumes de soude versés suivants :
V = 0 mL, 10 mL, 15 mL et 20 mL.
4/14
12 n : s a a a a : : ä : s :
' 30 N ' & Y )" N " » « N !" ü ... » N * ... °" "& * « » N 00 ... #" ee » M "
NNNNNNNNNNNNNNNNNNNNN
5 8 ! & ! ï & ! Q 8 ' 8 { 8
& EUR 8 ! * £ :! R' R 8 5 vi $ $
& 3 EUR E 3 > EUR $ $ 8 $ !? < 3 11 _ o. » «"ce .oä « » $e< ». « x.ä« » »: »É' « :. o. # « ee m'? ...... EUR» \ » .eË & « » ä« « « ».ä'A :« « wî .« ». « $:-- « » s<ï nnnnn & -'5 ! à" & ! ! 8 & 8 S * à $ $ à 8 8 8 8 8 à 8 i i 8 à à $ ! ! ! k' ! 8 à & 8 .ë 8 10 & \' N'." % ... ù' " R \X ? N' " M*& " ü aa " m N ! N & w$m " \N &*5 N & î " & QC N' " mg-æ " & "% N " \! ? R " "ÿ... \N' IN iv & ï *. S' } EUR & "EUR 8' ?! EUR 8 .* EUR & EUR & 8 8 «EUR % % EUR # ä & $ :( £ & > ( 8 £ - ! 8 £ 8
9 u» a » au .» .o.. «\ æ. » u u .a- oe-- .& 35 -n » nu ». .a- au ou » u a .& a.
o.-- :s a u a a .a- au a: a au «. ar. a u s u a: .u. .» « ax « » .« .* .«.
8 ! 8 & 8 3 8 & 8 à si ! $ !
i 8 ! à" ! ! ! 8 i 8 & & :'-- 8
8 ! 8 : ! 8 8 ii 8 ! i !" 8 !
8 » »: n'a: « ne -te* « » :x 't :» ou m'» »: 00 »:"er au :o: & a :« «'a» «: «
:*»: oo »: oË » « *» :« «* m*--» oe » »? ce au-- " ': » « nan: «: w
!* EUR =! EUR 8 # * Ü « ! > EUR 8 !
b 8 £ ! & ? EUR & 5 3 t * EUR 3
# < 8 & ! $ 8 * * !' Q 8 :R 7 « & w*n & a... "'8 a au & ds a. & &æ« & au «&». :x \ 3 ne » .-- a. a si,» ne « .* a m a 'n: a « üa\ù &» -- as a «e-- .«n ;: « a "'8 ..... i ! 8 & 8 8 8 I 3 ! ii ! 8 ! i 8 ! ï ! ! ! 8 i 8 i 8 Q 8 ! al 8 a 8 8 8 & 8 } l 6 : ! 6 »»»»»» w »»»»»»» we » « u- »: ee -oo » « » »: a »: ->u ce » roc » »: «' we :«
« » »: w «a » »»»»»»»»»»»»»»»»
i # * i 5 > EUR ( S 8 ! '! EUR !
.* < 3 EUR 3 $ 8' i 3 à à" EUR 8 ! & 8 * fi & * * .OE & 8 ! 8 $ 8 5 a a msn a: o.. au? a » u &: a. &. **); aaaaaa 3 » :: usa. .». & as*u & sa .: .a. m et &» au «\ .&*w & » of a .a- a {; * & »*au «a» .& i 8 ! ! ! ! $ ' 8 & 8 i 8 ! ! 8 S 8 8 i 8 ! ! ! 8 ! ! il * ! % EUR ! ii 8 $ & % £ 4 :o »: »)tnt « :» æg « 00 au * :» -w we!» :« to «r v n {: » nt «$;» ou « naçm ce »: 45 we :« « ÿ» »: «* vÿ«t « » :o( ce a» «et à: » v: ooäm «! we # 8 £ & k ) EUR 8 & 8 è * £ ! £ : 8 & U 8 8 & £ * £ ' $ * l 8 à ! ! à' ! 8 ! 8 & 8 :\ 8 3 s a m a a \. «a & ns a au u. un au s a ce & at « & us & u us.. a: aaaaaaaaaaaaaaaaaaaaaaaaaaaaa ! ! 8 ! 8 8 8 ! £ ! à' E 8 ! i 8 ! i ! ! 8 ! 8 I 8 ! 8 ! =OE ! *. ! $ $ 95 ! ! ? EUR 8 EUR 2 9 $ 4 ! i > ( $ ! 3 & >! EUR !
»»»»» v -- » ne .» w «w w » .« » »: w w »' « » au a v w a » ne « sx w w »' oc »
au w w «» ce » »: ce «- -»' on » « » « w w
-- ' ï & ü ! 'î & ! : ?' % & 8
' o « o + a x n :: a
| | | | l | | l | | | | | |
| | | | l | | | | | | | | |
1
--------r--------r-------r-------r------1--------fi----_----'-------1--------fi--------. ---------- | ---------- . _____ r-------r------
| | | | | | | | | l | | | |
| | | | | | | | l | | | | |
| | l | | | | | | | | | | |
0 l | | | | | | | | | | | I |
O
N
A
05
on
_\
°
..\
N
.\
&
..\
d':
_\
(»
N
O
N
N
N
à
26 28 VNaOH ( mL)
Courbe de dosage d'une solution de SO;(aq) par une solution aqueuse de soude
1.7 On étudie dans cette question la réaction, notée (2), d'oxydation en phase
gazeuse du
dioxyde de soufre en trioxyde de soufre :
2 SOz(g) + 02 (8) Z 2 SÛ3(8) (2)
On charge un réacteur, de volume fixé, avec un mélange équimolaire de dioxygène
et de dioxyde de
soufre à une température maintenue à 700 K.
1.7.1 Calculer, en utilisant une approximation thermodynamique à citer et à
justifier, la
valeur de l'entha1pie libre standard, A,G2 , de la réaction (2) à 7 00 K.
1.7.2 En déduire, à 700 K, la valeur de la constante thermodynamique de
l'équilibre (2),
notée K2.
1.7.3 Etablir l'expression du rendement de la réaction (2), noté 9 , en
fonction des
pressions partielles en dioxyde de soufre et trioxyde de soufre gazeux, notées
respectivement P802 et P803 .
1.7.4 Exprimer le rendement @ de la réaction (2), l'équilibre (2) étant établi,
en fonction
de la constante d'équilibre K2 et de la pression partielle en dioxygène, P02 , à
l'équilibre.
5/14
1.8 Influence de paramètres physico--chimiques sur l'équilibre (2)
1.8.1 Quelle est l'influence d'une augmentation de température sur l'équilibre
(2) à
pression et composition fixées ?
1.8.2 Quelle est l'influence d'une augmentation de pression sur l'équilibre (2)
à
température et composition fixées ?
1.8.3 Quelle est l'influence sur le rendement de la réaction (2) de la présence
de diazote à
700 K et sous pression fixée ? Justifier la réponse par un calcul d'affinité.
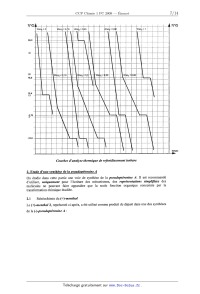
1.9 Etude du diagramme binaire solide--liquide SO3-HZSO4
On souhaite construire et exploiter le diagramme binaire solide--liquide de
SO3-HZSO4, mélange
couramment utilisé en chimie organique pour effectuer une sulfonation d'un
composé aromatique.
On présente ci-après un réseau de courbes d'analyse thermique de
refroidissement isobare (9
courbes au total) permettant de suivre l'évolution de la température d'un
système SO3--stO4, de
différentes fractions massiques en 803, indiquées à côté de la courbe
correspondante. On note Wso,
la fraction massique en 803 du mélange, la pression étant fixée à 1 bar.
1.9.1 Justifier les ruptures de pente observées sur certaines courbes d'analyse
thermique de
refroidissement isobare.
1.9.2 Il apparaît pour les fractions massiques, w803 = 0,19 et 0,60, des
courbes d'analyse
thermique remarquables.
1.9.2.1 Quel nom peut--on donner aux points du diagramme binaire
solide--liquide de
SO3-HZSO4 en ces deux compositions ?
1.9.2.2 Quelle propriété physique remarquable présentent les mélanges
correspondants ?
1.9.2.3 Justifier, pour ces mélanges, l'existence d'un palier dans la courbe
d'analyse
thermique.
1.9.3 Mêmes questions pour la courbe d'analyse thermique de fraction massique,
Wso, = 0,45.
1.9.4 Calculer la valeur de la fraction molaire, x803 , pour la fraction
massique,
w803 = 0,45, et en déduire la composition de la phase solide apparaissant pour
une
température inférieure à 36°C en ce point du diagramme binaire solide-liquide.
1.9.5 Construire, grâce au réseau de courbes, l'allure du diagramme binaire
solide--liquide
isobare T =f( wSO3 ) du mélange SO3--HZSO4. Indiquer, le nombre et la nature des
phases présentes dans les différents domaines du diagramme.
6/14
T°C * * ë % â & f % * * = s' = ë
. . .
< : :. A ' . t « . n l % { - "...I 'IDNV "'--' f. .Î'I'I'O'. ..'V' "'QV- "'lfi' ."- ! 'fiu'l' YM'ÛU' fl' "l'-"'" .... l\'l'u?o' .'h'uw' M'M' GÊOW. '.nv 'o' NMM' %'Ç'fi...' ""-"W" Mw- '-"Vl...' û' VI'MW. ""WÿWW'V'fi'fi'ñfi'fi' 'fi'fi'i'bfi'fi "vo"'1'vfi'fi'fi """""ÎWÙWÏ'ÊWÏWM' I'v- i'O'.VËI' l""W..."YJÊÏH -.V .Wl\ÏWIMÏ"ÊI l'fo V. \ËWM'D' fi\'o DV?" .... 'h'v'Ü'o'l'l 'äiw Nñ'o' "'"Ü't'u \\ "-- 'n'-'d'o' n'. "'. 'fi'Ï'. ."'Ël" D't' {E...- .'N ""-' "#Wfi'i'l l'Ü'-'b' "' .'ñ' Il" "' --\Ë'fiv--V-- '.N' ù' D'" .-\'Ç' 'n'. ..Î'. .'.'fi'ñ'kr.'.\s'.'.'ç'. ". ' .'.\'g'f.V.'o'-'q'h'n'u'fln : \ ' :\ . { \ ... 2 - . .; v. 1 A >. _{ ' '.
: : È _'=' ;q' ' "' È " ' "' ' È "
? '- ' : ! > > % = 2 ; ==
. ', ' . ,
; . -. >. .1 Z â - -- ' . !"
WSO3= 0_ : W503" 0_,_ 9 WS 3 : Oâ 45 $ 503; ' =0 ,6î0 : >- SO -- î i ' *
. . -- _ . v.
- ; 5 3 % ° = i -'
% e i := ; __ä . ' * ë :: 5
'.\'.'p'.'. .'.\'--'.'-'--\Ü.\'- \'- '-"'- ...? AN,--'."- '-W »... lu.
\".\..'.l .\l.\' %" "'--"" J-' --... 'J.Ü.\È\E\'A...u'- '--' 'n.-'-' -'.' A'
.l-- ' ' 'JJ.'\\U.' "'. ' .\q.' w ' ' Â'. ' .ä\'fi\...'æk"\\'-Ü-È". '\w-- '.'
A'.'<\'. \"." x"' ' ' \\' -'.' Au'. ' .... ' "... \... -\' -\...'A'v'-Î "'--' ." A" W--'M'- \\È\...'-- ...--". C' ' |.0 \' .--.-'--' -'«u- Ë'.'-'>'.'
."'.\'.'-- "."-- "--\'.'.' .".- '.\'\" "'Ê' ..... ...--' .'.\'°--". --'N ."
'-'.æ'. ....-- --\"\'--\' ." \\'--'- .'.\';\ "R...--fl. .E'A'.\æ C.". |... ..
'.lJJ-z;'--N'- -\' --'v\' .....
--'"--'--°-...-J...".."KOE'.'.'.l»\'.'AÈ'--'Ë°.' \'.'--P. \ \ °A'.\'.'.'
--'---' '-'v'. ... ..... .N\'. '.'Ë. ..... ...... \' .....J--\'$
( . . " ' !' .. '
3 : :- ; ; -: 5 ; . '.- î > $
__ . > .: v_ \-
'< 5 - ;-- :- -, : 3 £ ; à { :» - . ;" \ 5 2 ; --: ' ' - '. ' , . - . ; -:- a i 5 .: :. * z ' 5 3 à > E
; ; a 5 ' : E' 5 % È » ? È
?. .. '-' : ï : : '=' a ë ; ; :
. - - ,
'."'n'.\ ." --'\ .'.V--V--' --W "' v'.' -v- 'n' .N'vfi...fiP:V--'--\
\\'--"'n't\'o'o'Y"M-'Ôn'u'u'.\NNS'I.'.}'.'.OEV.W--w.äw-N\&î Vu '.'-' M'." "N'
.w.w ". -'-'- A' M'ä....\ËN MV."- f.'u%'\\\?'--' -'.\'--'M'u'--'n "n'-'. ":
5...\'.... .'v--W .W .\°.' -°\\'. .... ". w$' '-'\ .\'flM\'.'--\' 'ôfi'}'-'
'.". n'u"'-' -'--\".\fi \' .'N '-\'-'--W --.V\' 'uë .N'W. ... J.... .... "...
\\" --'\Pu' .' 'n'--\"æ' '-...'- '-W ."--. 'M .....)
'.'u'OE--'v'nt'u'v'-'--'-_æ'.N'--\%'.'.\'.'.NN'.\'EN'-'.';\Nfi ". '-- .'À':'.\
' '. \ 'n'--'-- ).'.'--'>.'.'>'u'à'-- «' -'-'-':=.'.'.'. . . '-- \ .'.'=
.- . - '. _.: '. ' \ '2 ' '
; â : : ; % È ;" % i ; % $ ; : : % 5 ii
.' ' '. - . .
. , -. . . 5 ,\
. 2 "." ' A . '. Ë ' ,: } î -' :' * '\' 2 EUR
- . . ' \ . .' ' \ - -
:_. '- '. . , !- ; È ' Ë . :: " .' ' '- Ë { ,:
._ k { 1 \ : \ --. '- ' -. -: ' 'v ' ' '.
- - : a i * ë ' * ' ' * > = = EUR ,.
, ---4------P-- ----?-------;-----_--_---- ----- ----- ;. È ' i % ! { Q ._ .: -
Ë .. I
.' ._ . & â _ _ - ; ; '. \ '. ) : :- " 1'
$ .. . . ,_ . a - _ :; ( \ _.
< : :: Ë . : Ë : ; à s . . \ '» - :- ,_ . -' i ' -. ' ' \ -. Ï ,; s'--'. -.-. '. °. .'.'ë--sv-- \ \vfi$'..'-VË-'1'\'v'\n 's \ r.-.-.ê.æ-æ. nav--vac.-f.æv.}v.-.-n-.væ.'. .'A'-- r'n'.:r'- .". ..v - «ns--. .--°.va '.W '-.v -.\ë\'u M '.\. '.". .». -'-'-'o'.'.\4\ .". «'n'--sv .'.'- .*. '-V .--.5--.--.--.wv.-.v -.xx-. '.v :. .'-'.\ .". . ....'î\-uu.-.-..-. .-.s -.'-.. 'v. v- .... -'.. '..'.'--'.'--'.5v--'.'--' :»v---v.-.'c.v--vfivfl'. .'.\:--'A \'v \\ '.:.-. '. \ '-'.'-%'.'.'. . '.' -.v.a'.v:.°.vÿ'.æv. -.--.- ":s- --.--.5 '-V-' .'.'.:Ï4.w. \ . . .':' ................................... }_ ...... .' ..... \ . . . .--. .'.--::.- ....... \ """""" .'; ................................... ; < 5 .. : .* = 3 " ': ': t : 3 > è & :-
' . \ ;._ .; .! . . . 2 " '. -:
; a 5 -= a $ & ; Ë % ë : ; È :, .<. ?. -.- __v .. . , _ . . . -_ '. '. :. : î ; a ; ; .: : k « ; ; 5 : =. >. . z 3 >. ;:
:: ; < : ; \ '; = 3 3 '< t ? EUR 3 '$ $ } EUR 5 3 ': ._ . . . , _ . .- .- :- ; ;. : : ; ? ; a t : EUR : ; \ ' -: ; .' <; ; ; _; =: $ î % } :Î ' i 3 * i "' \ Ï' \. ' . o ' . '. : ;. à ' . -. & - 'M'o '-- W.'A\\wl.'-'A'--'Nflfl'--N'Mfifi J- "" "I'." ""'I\- .""'q\'fh"W-fi'v' fl.\}'w .N'- ""... .'.\'M'--î'.fiMv--N"Nfi '.' M'- \5'.wñ'bvfi'-' \'.Mw.\'.... ......W' .'ufi'k--'v "... \\"fi'.""Wfl--" "R"MfiM--'fow--w '....u'."\\'W--N' .vvævæ."w.uwa\ "'-"59." '.ÈV.'.\' M"'.Nw .'. "- 5"\OE%V-' .\... \""...w-'nfiä S'-'Jfi'b .'v.sv.'.n"."sm--.x--.v.&W--vfivæss\v&wssv. .'.'vVh\' '--'V .'-"n'-" MME--' '.'. "... W .'1 '.'-- '.'h' v\' -".._ '::u' '.W .\'»\' .'.'-'-N'. \'. '.". "ë . . ... ; E E . g ; â : $ % .: ». ;; % : ' ' \ \ " ' ' <= E S 3 :: 3 ' 5 "= 5 i ; n. "\ ' :; .\ < !. :- È_ \ È :; s ; @ Ë \ : " - < : Ë ' 1. \ --- . i ' \ Î ; , » â { " Ë .* " ' ' . . _ i & Ë 3 O '.'lV.'--u N.--.'-'W M5'ffl\%m'--%Yt W\B.'.Ïc. .I'UVI "fl . ffi'. V. 35?" (.I'--"' l'i' .'vw.'. .N\'fi.'fi'--y.äYü.-. «, _ "' _ , \...êfi _ , '.'ñf Y....'...' CNW- 'V:--'b""'u 'ù'l"'l l'ñ'l' !.'TM\,QÏM_OE. .H'V_h*'. m...". M." wû'"ny w""' "' "'! \' I"' fi'IN 3"' M'i'Ü'""' I'M. " 'û"' "' I'."\YNÜ"Æ' !. 'D\VÇ\" wñ'ë't ""Ü'bfb' ". 'M"ÙYD'I\'ÜUÈDNV.'M' ù"hfifiä"'ääfÿWû'û...'--Vfl. w.'n' .... _'.W. 'd'. '.'f "; \'u'o\\vJ.'-'u'.'.\'ç\' .'ë, ; t ' : '; ; - ' : :- : . - ' :< r. " . .'; $ ; i ' <:-- " à i = 5 * î . i 5 ; ; g g i e ; _Ë 5 i _â ; ; '; ! Î ; ': | . \ : . A 1 \ ; , î ; % =: ?! % % < : ; ë " ' 'ï ' -2 >. :
o;-.-.-æ. -.-.-.-.s--.--æ.au' ;v.u.u. A' æ.-.- æAu.ù.t -.v --.-. äuu. .'...avæa
. -..-.v -EURMA"AvM-. .-Ç«.. -.u «av.-.-- v v:--2 ;-:Mv '.va vu.-. -.u.-.- AND:
t.».o' wma ' .'J--'AWÆWÙ; ' ' v.'v;o;o; """" -.qu.vuæ.æv«u '" 8 â % ' "'- : 5 ; ' "'
l - . EUR : ": î- \ ë
% : - : ; » ï ; ' ;.
- -' .4 2 : 3 :. s
' ' 33 e ' EUR %
â . _ : ' I'
l' " '
; : 5 â % 2 a : $ $
: { . È ' ;.
».v.- »... wma--«bv-- -æ....--.--æ.æm--. æwææ.wwwavwËwmwumu ...v
...-avw'g...... mv... .... v .-.--.wv.ÿ- M..."W'ù'bfihfiu ..."... wwmv-- W"\\
wav--mwa 5--.u...«ww--.ä.m--amwm-- %...'MVA' mvaæu--æ.vw
àv.--.--.-«waævæ.--ææ.--ï
= : ë ;
-: . , \.
} È 5 : '. î } ;;
5* '; : » = > =
'» '. " { : $ "--
t - î » : î . ; : -- ë
' ? : = : :'=. 3 »
Ï ,: : i ' fi ' ;
:_ ; & : 5 =; } * "'
. .
new. v.v.wvw.vw-- ê--mwm-m.w a... mmmÿaw...wæma w-mmmww www......mm v. -
vwvvwsv-- ..."Wfiw'm5OEvfi-«M'YMVfl-OEN ..." .... swvsæ-wæv. +. «mv-m
vwvw--æwæwvwæ ""-v"... www.auva m"æ"æfihV--lü\fiwæw--"mæææa ". à ; EUR
' ; < ' - i \ " :. â % s s ' a g a ; ; _ % $ ; ! A " ' . 0 ...-.». .- vu...-run av.-rr on... ... ... -.-o . ...vvnu. -.--.. www.-voeu". .<.-. ..."-nwawmnn - -- un . - 'o'n'. svn-...... -'. ."u .: ..Èo u.:o'.'.\'«l'u'u'q:ræu' 'ruï-'.'o --».-u-n--n- . »n-v-**-.unwwuu .--.uvr.-n-u- -uu . .- 'q'.\.:u\'.'- «rev-'. .-. .*.y'cr.:.-rw-. r.--u- un ...un un... ... ... ..èun "w.-"m rut-- '-- «...... -.. --..- .---... ..--.. -u <--.- --.. -.-.-.-.-o--n---. «u...-«%- -... u-'-.. .. ...-Q.. .... ......... -. -ân . ... . . . . . . .» -.. -. . .. ... ..-. ."... --.Ë- ......... " ...... <. ' 2 ' .. a : = » "% ... . _. . W03" - 'SO3Î= " 3 -- , r ; 03= , = s- : "' s :; â -- & % ----- ---------- -- ------ ----- --------di---- ---- -- -- ------ ----- <" ' g ' '3 É . _ - v ' à g i : "'--W. '--AL"U--Q\'v'. u..."... ... u""'--...NÀV " ""\KMÀ4À'AM'AMWKOE'. ...""'Jfl. '...." '...." 'J--'ËA--'-'J.ÂM\... "\"MN"k""Y'--k"\fi... \"Û.\'--..."'. '.\Nu'--"Q"u ...--.... Ah!--MA". \...A"\NÜJ--'--fl î...\'J--\'J--N£L"\KKË " M."NI.R\\KK'.Ü.SKÆOE .k\\fifl\',--u--'--Æ' ' " '. ' ...--' '.'.E'.l.\'-'u'.ä'--' '.'JË ): ' h : :.: EUR 'A E = ' * » .-. 5 i ; a ' i '" .-. *. i'-î ' A ? Ë { p .! z \ 3 ". " A .A :- . ; S ' .. ' __ . 'M'.v '....SfiwM' .... '- "WWW ... "WoM"\ u...... "N'." \...'Mm '...mflw"ww' \..."S" ..."V "W"... "';--W A""'*?ü...'"w 'M'.\*...'vWæ-Wg'Mfl-"N'v"\" ...v--R"HWV-- '% , _ ' . i ; ,.- , à t ' 3 I * '; :* : . \ : = EUR :' \ Ê % .- £ . ... EUR ? É S = ' ' $ ". . i . '.'ÿ'fl'i'l EURu'oVfi'fi'flï"-\"VÙN'I Vl'o' u'b'M'fl'v'b' !'I""'O\\' I'l" 'l'ë' "ñ fi'fi'l'ffi\ - !'fiWü"Wü... . V...'Nfivfi " ""'V'M'D'IN'I _... "' _ ..."'fi\'MÏ W\"Ï\'M '- wvfivfiM'-_fln"wv--vfl' M' OW &%'O'n'V"YI'-'ñ'f...' ""\"--""' M\' ""'"...Y" Il" I'*'U '... \' lî\fi'v'.\ V'M'fl """--' ." ""... I '... ä"'M fifi\v.'\wfi'fâ'flñ""wfifi"""fi 5"'\\"W\5'...'b \"\'fi'l'u'-'M' V 'I'fQV' 'I'H" % ' ' i \ fl 1' \ ËW ' ! ? i E »: >. , : _. ';
i ' , :
} .-. : !. - % ,;
* EUR : î : ! '-
: 5 _________ä " E ' 5 ' ' ' ' °
'. ' " - " \
-- - -- - -- % È ; _ î :_ È } È
flÎ . ' ' 'F. ! '. '» \
10 ...... ; ... ...... .... _ . . .. ... .. ., .. . .. ...... ....... .
................ . ..... ...... ....... ........................ ......
: < x ' '- "'3 5 :: _ : * = 3 : : u ; < '« i : Q - ; 'A i _: - -- : : \ ». . _. ... . % _=_ ; . ; ? .. î ' â .' _; : 5 ' ; } .: .'.\'A' '-W...'fl"u"M--'ÀV--ifl...'M'-ÙMW '}N--...A' " mfl.' &"JflMM ' ...à"...à--LËN'v'J--VM'JJ4ÀN )"...Ü-'v ' 'A" "..."--'A WMA" ..."..." : ... ' ".... M...... "... ......M'N'ufi- ...'Aww......" ...'u..."" " "MP. WW}. muw-æ.wçæumæwmæ... '.'m. \'.\\'A"l .". \.-'.U "\"-w '- .'-- "' .L' M' .". 'ÀM' 'v'o . ,; % 2 a % % z % 'Ê . î !. EUR & Ë ? & %-- ; 3 i" ' \ : 5 ; 3 & -- :. ' % .w'w-- '.". M... m'...vv--s vn...'tæN -"'M'-V--flMÊ«V-fl ...... " ..." ""... - ... Qu...... % & î ?: O------- --------- )- 0,70 " \\"m'M'v--W ... 'fi "'fi'f.V"... « ..."'fivfi %w"mflfi'v&v"wä\wfi'fl'flw. -Y\'-'. 'r-W--'vw--'ç'dflvæ-Wê M-- %VMY.... MWv-MwæäVrî u'M'M'f-V-W '."W'v O . *u'.*n'n'ùï'u'.'-'--n--- -- 'n'n'u'o'u ... u'- .": .- o .. -n u . . - . . . A'o' . -- n'l'o'o'f0't'. c'ù'o'n ."o'n' ....-..- -...........-.».-.-... .--. _.,.___._,_.___,__._,_. ..- ...-. .-. <... .... <.4.» .... -.. n...»... ._.. ..... .-. ..... . "... ._ ' '.' % ... î JN""NJINI}.'JÊ\M'JJ"WI£W&È.WJ % .«-A\uaumh\%uæqu% ' ...--AAÎ...AM... "«..." _w;.i'ur--'-wn:u'v--mp'{ünptn)re.... . n. onmzmnm--nzéomunwn:wt ' IJ...\W.O... M..."... «kw--. .-.u.- Alu. Mwuä. u.-.£u.'.n. u. .... %. MAJ--"&...".NMAA ....--.uau È hummm--nui} >nm:--z-.u:utnxr--x)v
î
«Mkv--'."... ; . \...'M--K ..."\V.'w
â
-»»%
%
xm...;w :«.
...
))..."X--'Jfll'x'vx- m):1m ...un.-
»
' ' ' ' ' ' ' ... ... ' .
- | 0 , 0 WM www.--ur «ru... w*ww wmv--Wu *... '-'- ...... - " ""-
l'b'lh'oït l'OII "I'Iîl'UJ'IJ ". |_'l ..I'I.l' ' 'l '.'0_ I:.
OZI'IIC'I'U'U\'IîIN.I \'I'Dîl' 'III'I1I'.N'III'III'III'l3I'DII'I_ I'. l: ' If."
ÏZI" . ': I' .. . .. . Dïl' '.. ! .. "if. t' I' l' .. o'l .O'IÎ' CÎI Ii". .I à
C' I "' 'I' . 'Ol'n'l ":0' t'.. - "I. I:" " . "ÏC'C' .'DZD'OID'. . '.:D'fi'l '
l'..'.'|' ... .I'. lZ| C'UN' . .10'Qîtîliifùll51fiît'lî '
'OEI'OEOÏOEflC'OEU'ÜJ'GNIZ ! ZIÏI"CJËIZTÙÎIZOEIJOEOZYOEE -
'lîo'l:u'nh'flo'o:t'|:l'l"lï"ül ' :.
Ù'OEC'UZO'XU'O'JDZO"Il"°'(C'UIO'DI'CZI'CWCIC'UI"Ih'.'I' --
'æt«
hb'rm!ï"hîoähfl?)W...üp...bfi
. vo'o'u-o'u'u.
nt.""v....« au...---
.' ......mæa--xm
i...
a
E
".'ù 'MW+--r 'n'--w. ..5'ùvË. .am--nænmævæwæ
W- '.'. .*nvvfi". '«uv. '-
%
'Mâ'...'fi... '
Ë :
&?...wwws www.--«m ""'-"ww... . ...'ù'hfi Was"
â £
&
\va--"v--v--
â
...
...«wâ
%
î
...ë
î...
;
\"Vfl...."Ve
.:!p'p1urnn'uv :crl:-;uzmzhr.znx.
......
Ml
\
.......J»%..."w}
i
... wwwwwwYm--nvawæwæ ...'b'."--\"VÙ\ ä'ÿ"...'b'o'v'owfiw ....v--"sfiww
1"YüV-VM"Vn
;--.--oe.w:«Mæ-Wm- 'dhôüw...dEURmfdflfædttfl. rr«m«.ch«m «eaku:
YùV.VùV--'u oY. v.v ?. mwaM'vfi' .vn
â
;
ê::æ4...æf...aæffl...
.
ç-. - " .ru-n'a -'-*o'c' '- n'a-uv... . n . a. . n - . ...-n . . . u . - -' . .
.. n . u . . . r. n'...
È
%
\\uæawmuæmn .sa\...'Mfl--MA .av.-.v.--.gwaæu. «WO--M$ A'.h\fl\fi\À «mama--.n-
.". ...... .u.'.«v.«vAæ 'A'.\
â
i
...-M-. w.--. \'--'.v--\v .v .W\'. "V. W\"\...\\Ë\M\...sæ\"akæ_
'.
2 É
"svn'deWä-æsæwæv n'a. ?. «'... ..uvsmsæmv--%v -\V\ Nüv- \' wîæu. 'm ñ'.'o'-
M'--'.
n' .. . .-rr. n'u . u 'n o." n - - .*.'n .. .
""NIJAW- _...'W
-.
.
.
-'I
.
.
3
.'
.-.-.'n .. . nu...-urrurn'u ur"... .... 'n".-
:u . . .... «;;--:«æhïor-4nxoïpoeabïr '
!'
MM....'IWWW'W
...:-'n a.--vmnæ:<-ïg;ærpxxmm...a '.-....--.nu. no.-. -..vu.-. M...'t\\\... K\"O.M'.\ ? :...nx.,n.4 Mil--$" :... ...s... MW ...æfiw--M""fi\ ..."--- "WJ--mv-- H.W\Ëæ\wæv "uw--Ass _... ...'M »...-.:.umnnn- ;.nn..--,uumæx_ . . .». :.- rw.mu«wæ.-- .4.--.--.-----1.-.--.æmncwæaæàe «v.-u.:.:wm---aûæmm--vü'avrn "'.va" ' . WM"\M&N 'A'ù'fl'fi'flhm «& """"? % ;.«rm. îPïfi"ll.üîrfl '. ._. 'u:-:.'«-'.:.-.:o'-:.'-:u. .. o'--:u'o:.'.:o'fn'u:cQ-.:.--:.-.:.'-:nw.rn --.:r --'.:n:n:- | .---u:nzn.. . -.:.---:.-.--*o:o'u . . ...-.:. .- à 3 % ' _; ::nl--..\:n'.'ro..'b.c'b.clo'u \... |'.:'::.o.o.l:...'t. .:....» una-:w- .... .... ... ;... ... rr.- .. 'n'...- 'ë ""'M'îJ-'AWNA'À'Nmî 'n'--""..." nxn"th)n1ïtr) vg-J;'--unxnno{...)mrynflry . m:o;- fin:--nn1--,ÿz.:--»r.--ymxmv:äxvmæn-- .m>>nm>æ:ümx vox--rmn:......x
. -«utfdfigfrlælä«M-fitmæ;meL«!...«anfwr
'.
... 'A"...A'A'mv-'A'N--'MOEW ...MM V "' "N'--""......" ...c'- M' ... WWW...
"c'-'."VMWOE' ..."S ... ......Wfi'N; -OEVM...'\"\ \\Mä'M'ok'v'ñ-'h ...""'A
M......" JN. V. 'n'-
. !
i 5 .:--
' :
% < . $ :* q ; ' - ; a _ : ; :-- . < ; - ; ': ! _ . '" " " 'n'-- ' 'û " "'n'. ' n\'b \ "\"--S'. ". 'fb'u "' ' "'.'v'o'u' ... -' \"\M'" \ 'n'h '. \'."'u\'ñ"5 \\V." S'. 'n'-\ "\ "' '- '.'.' ". ' 'A"'n'.'o'." ' '- î ; ...""'v. '. wav. av.-ww" ""'"... «nv. vs " "'A ..."- """ ' 'W. ?. ....1vmnç."flv ... lmvvvr' V"- ...--n..." .... umvmfi "un. . f.- Courbes d'analyse thermique de refroidissement isabare 2- Etude d'une sxnthèse de la gseudogte'msine A On étudie dans cette partie une voie de synthèse de la pseudopte'msine A. Il est recommandé d'utiliser, uniquement pour l'écriture des mécanismes, des représentations simplifiées des molécules ne pouvant faire apparaître que la seule fonction organique concernée par la transformation chimique étudiée. 2.1 Le (+)--menthol 2, représenté ci-après, a été utilisé comme produit de départ dans une des synthèses Stéréochimie du (+)--menthol de la (--)--pseudoptémsine A 7/14 T( ° C) temps (+)--menthoI 2 2.1.1 Que signifie le signe (+) ? Représenter le (--)--menthol en adoptant une représentation spatiale similaire à celle utilisée ci-dessus pour le (+)--menthol. 2.1.2 Combien de centres asymétriques possède le (+)--menthol ? En déduire le nombre de stéréoisomères de configuration du menthol. 2.1.3 Déterminer la configuration absolue des centres asymétriques du (+)-menthol en justifiant la réponse. 2.1.4 Quel est l'intérêt de partir du (+)--menthal en vue de la synthèse de la (-)--pseudaptémsine ? Argumenter la réponse. 2.2 Etude de la réactivité du sulfate de diméther La lactone 3 est traitée par de la potasse, KOH, en présence de sulfate de diméthyle, (CH3)ZSO4 dans le DMSO. Le sulfate de diméthyle réagit de manière analogue à l'iodométhane, CH3I. \ lactone 3 O 0 OH 2.2.1 Ecrire le schéma de Lewis de l'ion sulfate, SOÊ'". Prévoir la géométrie autour de l'atome central de soufre. Préciser le nombre d'oxydation du soufre dans l'ion sulfate, SOÎ{' . 2.2.2 En déduire le schéma de Lewis du sulfate de diméthyle, (CH3)ZSO4. 2.2.3 Proposer une réaction illustrant la réactivité de l'iodométhane vis-à--vis d'un nucléophile. 2.2.4 Justifier, à l'aide des questions précédentes, que le sulfate de diméthyle a une réactivité analogue à celle de l'iodométhane vis-à--vis d'un nucléophile. 2.3 Réactivité de la lactone 3 On suppose dans les questions 2.3.1 à 2.3.4 que l'action première de la potasse, KOH, dans le DMSO (ou diméthylsulfoxyde, C2H680) est celle d'une base. 2.3.1 Quel est le rôle du DMSO '? Rappeler ses principales caractéristiques physiques expliquant son intérêt dans la transformation chimique étudiée. Argumenter la réponse en s'aidant du schéma de Lewis du DMSO. 2.3.2 Indiquer le(s) proton(s) acide(s) de la lactone 3 vis-à-vis de la potasse, KOH. Justifier la réponse. 2.3.3 Représenter la lactone 4, intermédiairement formée en présence de sulfate de diméthyle, (CH3)ZSO4, et de potasse, KOH, agissant comme base. 2.3.4 Proposer un mécanisme pour la transformation de 3 en 4. 8/14 On suppose dans la suite des questions que l'action de la potasse, KOH, ne se limite plus à celle d'une base. 2.3.5 Représenter le composé 5, ce dernier pouvant être ionique, résultant de l'action de la potasse, KOH, sur la lactone 4. 2.3.6 Proposer un mécanisme pour la transformation de 4 en 5. Le composé 5 se transforme dans le milieu réactionnel en 6, de formule brute C14H1804. 2.3.7 Quel est le nombre d'insaturations de 6 '? 2.3.8 Représenter le composé 6 finalement formé par action de la potasse, KOH, et du sulfate de diméthyle sur la lactone 3 . Nommer les différentes fonctions organiques du composé 6. 2.3.9 Combien d'équivalents de potasse KOH et de sulfate de diméthyle sont--ils nécessaires pour réagir sur un équivalent de la lactone 3 '? 2.4 Hydro génation de 6 L'étape suivante est une réaction d'hydrogénation chimio-sélective du composé 6 conduisant à l'obtention de 7, de formule brute C14HZOO4. Le spectre infrarouge (IR) du composé 7 présente, entre autre, les bandes caractéristiques suivantes : - bande large vers 2960 cm"1 ;1 - bande intense vers 1750 cm' ; - bande fine vers 1600 cm'l. Le spectre RMN 1H du composé 7 présente les signaux suivants : Déplacement chimique Intensité relative en nm du si, al . du si, al ' : ' ' : ' 2.4.1 Rappeler les conditions opératoires requises pour effectuer une réaction d'hydrogénation. 2.4.2 Ecrire une représentation schématique simplifiée du mécanisme de la réaction d'hydrogénation. 2.4.3 Pourquoi la réaction d'hydrogénation de 6 peut-elle être chimio-sélective ? Représenter le composé 7 alors obtenu. 2.4.4 Attribuer les bandes de vibration du spectre IR de 7 correspondantes aux trois valeurs indiquées. 9/14 2.4.5 Attribuer, aux différents protons de 7, les signaux du spectre RMN 1H ; justifier leur multiplicité. 2.4.6 Quelle pourrait être la multiplicité théorique du multiplet observé à 2,6 ppm dans l'hypothèse de constantes de couplage identiques avec les protons voisins ? L'action d'un réactif adéquat sur le composé 7 permet alors d'obtenir l'alcool 8, dont la structure est représentée ci--dessous : OH alcool 8 OMe OMe 2.4.7 Proposer un réactif ainsi qu'un solvant, dont on justifiera le choix, pour effectuer la transformation de 7 en alcool 8. 2.5 Oxydation de 8 et réaction d'Homer--Wadsworth--Emmons L'oxydation de l'alcool 8 en aldéhyde 9 se fait en présence du periodinane de Dess-Martin, représenté ci-dessous (les doublets d'électrons non-liants n'étant pas représentés) : OAc ACO\\ /OAc |\ 0 @ Periodinane de Dess-Marfin Ac-- : CHgCO- 0 2.5.1 Justifier la valence aussi élevée de l'iode dans le periodinane de Dess-Martin. 2.5.2 Préciser le nombre d'oxydation de l'iode dans le periodinane de Dess-Martin et prévoir la géométrie autour de cet atome. 2.5.3 Proposer un autre réactif dont le nom et la composition seront précisés permettant de réaliser la transformation de l'alcool 8 en aldéhyde 9. La transformation de l'aldéhyde 9 selon une réaction de Homer-Wadsworth--Emmons se fait en présence de tert--butanolate de potassium (ou 2--méthylpropan-Z-olate de potassium) et du phosphonate 10 représenté ci-dessous : EtO \ EtO--fi O O phosphona te 10 0 2.5.4 Quelle peut être l'action du tert--butanolate de potassium sur le phosphonate 10 ? 2.5.5 En déduire une représentation de l'anion alors obtenu. Justifier sa stabilité. 2.5.6 Par analogie avec une réaction connue, engageant elle aussi des dérivés du phosphore, représenter le composé 11 obtenu par transformation de l'aldéhyde 9, selon la réaction de Homer--Wadsworth-Emmons, en présence de tert--butanolate de potassium et du phosphonate 10. 2.5.7 Préciser le nom de la réaction analogue à celle de Homer--Wadswoflh--Emmons. lO/l4 2.6 Formation du composé 12 Le composé 11 est traité par l'acide trifluoroacétique et conduit à 12 dont une représentation est donnée ci-dessous : OMe 12 Afin d'étudier l'action de l'acide trifluoroacétique, CF3COOH, sur le composé 11, ce dernier est modélisé par la lactone 13 : lactone 13 2.6.1 Représenter les deux intermédiaires cationiques qu'il est possible de former lors de l'action de l'acide trifluoroacétique sur la double liaison exocyclique C5=C1' de la lactone 13. 2.6.2 Lequel de ces deux intermédiaires cationiques est le plus stable ? Justifier la réponse par l'écriture de formes mésomères. 2.6.3 Indiquer quel est l'intermédiaire cationique issu de 11 conduisant à 12. 2.6.4 Proposer un mécanisme pour la transformation de 11 en 12 sans se soucier de la stéréochimie observée. 2.6.5 Quel est, d'après les règles de Holleman, le substituant de 11 favorisant la régiosélectivité de cette réaction? Justifier la réponse. 2.7 Fin de la synthèse de la pseudoptémsîne A Une suite d'étapes (non détaillées) réalisées à partir de 12, sans modification du nombre d'atomes de carbone de 12, conduit à l'alcool 14, de formule brute C1gH2803. Celui--ci, traité à nouveau par le periodinane de Dess--Martin puis par un réactif adéquat 15, conduit au diène 16 représenté ci- dessous, dans un mélange 3 : 2 de deux stéréoisomères : : OMe diène 16 2.7.1 Représenter l'alcool 14. 11/14 2.7.2 Préciser la structure du réactif 15 permettant d'obtenir le diène 16. Quel type de stéréoisomérie présente le diène 16 '? Le diène 16, traité par un acide dont le comportement est assimilé, pour simplifier, à celui d'un proton, noté H+, donne un composé tricylique 17, ne présentant que des cycles à 6 atomes de carbone. Pour étudier cette réaction, on fournit, en données, les orbitales moléculaires obtenues par un calcul de Hückel du 2--méthylpenta--l ,3-diène modélisant le diène 16. 2.7.3 Que représentent en théorie de Hückel on et B ? Les nommer et indiquer leur signe. 2.7.4 Quelles sont les orbitales HO et BV du 2--méthylpenta-l,3--diène ? 2.7.5 En assimilant, pour simplifier, le comportement de l'acide à celui d'un proton, H+, quelle interaction prédominante PIO--BV faut-il considérer lors de la réaction du 2-méthylpenta--l,3--diène et de H+ ? En déduire la structure de l'intermédiaire cationique formé lors de l'addition de H+ sur le 2--méthylpenta--l,3-diène. 2.7.6 Représenter, sans se soucier de sa stéréochimie, le composé tricyclique 17. Proposer, à l'aide de l'étude orbitalaire précédente, un mécanisme et nommer la réaction responsable de sa formation. Il a été envisagé, en vue de l'obtention finale de la pseudoptérosine A, de coupler en milieu acide les composés 18 et 19 représentés ci--dessous : 2.7.7 Nommer la fonction chimique obtenue lors du couplage en milieu acide des composés 18 et 19. 2.7.8 Proposer un mécanisme pour cette réaction de couplage en milieu acide des composés 18 et 19. Le couplage du composé 18 et 20 a été également tenté et a conduit à de meilleurs résultats que le précédent. 2.7.9 Proposer un réactif, non acide, pour transformer 19 en 20, sans se soucier de la stéréochimie de cette transformation. Préciser l'équation--bilan de cette réaction. 2.7.10 Proposer des conditions opératoires adéquates pour un couplage des composés 18 et 20. Quel problème peut-on rencontrer lors de cette réaction ? 2.7 .11 Quelle suite de réactions permettra alors d'obtenir la pseudoptémsine A ? 12/14 Données : Numéro atomique : Z(P) = 15, Z(S) = 16, Z(I) = 53 Masse molaire (g.mol") : H = 1, O = 16, S = 32 et Zn = 65 Electronégativité: on peut considérer que 0 est plus électronégatif que la plupart des autres atomes sauf F Règles de Slater : On rappelle que dans le modèle de Slater l'énergie d'une orbitale atomique associée au nombre quantique principal n est donnée par : 2 z s(n,l) = --13,6-( eff) ,en eV (1 eV =1,6.10'19 J) n La charge effective, ZEURff , est calculée par : Zôff : Z "' 6 où Z est le nombre de protons et o la constante d'écran calculée à partir du tableau ci--dessous : contribution des autres électrons niveaux niveau autres électrons du niveau n niveaux groupe de l'électron étudié Rayon covalent (pm) 1 25 Rayon ionique (pm) 70 Données numériques : Nombre d'Avogadro : NA = 6,02.1023 mol"1 Constante des gaz parfaits : R = 8,31 J .K'l.mol"1 13/14 Données thermodynamiques à 298 K : pK...(soz/Hsog) = 1,8 ; pK A2(Hsog/so3') = 7,2 Enthalpies standard de formation, AfH°, entropies molaires standard, S?" et capacités molaires standard à pression fixée, C; : ...-- Données spectrales : RMN 1H : gamme de déplacements chimiques : -- -CHz-CO- R-COOCH- -CHzOR 0943 mon 2,2-2,7 ppm 3,7-4,5 4,7-6,2 7,0--8,0 IN FRAROUGE : nombres d'onde (: de vibration de quelques groupes fonctionnels Gr'?"pe on CH c=c c=o fonct10nnel 3300--3600 2910--2970 1580--1620 1735-1780 Orbitales moléculaires 1: du 2-méthylpenta--l,3-diène : On rappelle que le substituant méthyle est décrit, dans cette modélisation, comme un hétéroatome à deux électrons et défini par les paramètres : ocMEUR : a + ZB , BC--Me : O, 76 . 2--méthyipenta-1,3-dîéne fil 3 1 Energies et coefficients des orbitales moléculaires 7rdu 2-méthylpenta-I,3-dîêne Fin de l'énoncé 14/14