CCINP Chimie 1 PC 2000
| Thème de l'épreuve | Variations autour de la réaction de Diels-Alder ; étude de l'ammoniac |
| Principaux outils utilisés | chimie organique, thermochimie, solutions aqueuses |
Corrigé
: 👈 gratuite pour tous les corrigés si tu crées un compte👈 l'accès aux indications de tous les corrigés ne coûte que 5 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)







Énoncé obtenu par reconnaissance optique des caractères
SESSION 2000 PC008
A
CONCOURS (0MMUNSÏOlYTECHNIOUES
ÉPREUVE COMMUNE-FILIÈRES PC -TPC
CHIMIE 1
DURÉE : 4 heures
Distribuer aux candidats une feuille de papier millimètré
L 'usage des calculatrices programmables et alphanumériques est autorisé
sous réserve des dispositions définies
dans la circulaire n° 99--018 du 1 er février 1999 -- BOEN n°6 du 11 février
1999.
Mise en garde
Toute démonstration illisible ou incompréhensible sera considérée comme fausse.
Les parties I, et II sont indépendantes
Tournez la page S.V.P.
J. 0997
PARTIE 1
Réactions de Diels Alder et dérivés du cyclopentadiène
Données
' Masses molaires atomiques en g.mol_1 : H : 1 C : 12 N : 14 O : 16
- Numéro atomique du fer : Z = 26
° Données spectroscopiques IR
Bandes caractéristiques d'absorption (en cm4)
de quelques groupements fonctionnels
C=C (alcènes) 1625 à 1700
C=C (cycle aromatique) 1550 à 1650
C=O (composé carbonylé) 1660 à 1740
C=O (acide carboxylique) 1680 à 1730
C=O (ester) 1700 à 1770
C=O (amide) 1650 à 1700
C= O (anhydride) 1700 à 1880 2 bandes
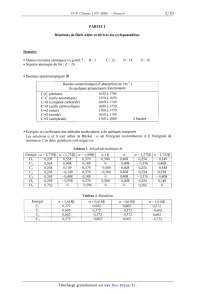
- Energies et coefficients des orbitales moléculaires TC de quelques composés
Les notations Ct et B sont celles de Hückel
résonance. Ces deux grandeurs sont négatives.
Tableau 1. Anhydride maléique A
: oc est l'intégrale coulombienne et B l'intégrale de
Energie ou + 2,7765 01 + 1,732?) 01 + 1,496B 01 + [3 on 01 --1,272B \ 01
--1,73ZB
o' 0,205 0,558 0,379 1 0, 500 0,408 0,254 -- 0,149
C2 0,365 0,408 0,188 \ 0 -- 0,408 -- 0,576 0,408
C3 0,205 ' 0,149 0,379 --0, 500 --0,408 _1 0,254 l --0,558
C4 '1 0,205 } -- 0,149 0,379 l -- 0, 0500 0,408 0,254 \ 0,558
C5 0,365 -- 0,408 0,188 0,408 -- 0,576 -- 0,408
0, 0,205 l -- 0,558 0,379 '0 0, 500 -- 0,408 0,254 \ 0,149
07 0,752 \ 0 -- 0,596 \ 0 i 0 0,282 \ 0
Tableau 2. Butadiène
Energie 01+1,618B a+0,6180 } 01--0,618B 01--1,618B
C1 0,372 0,602 \ 0,602 0,372
C2 0,605 0,372 \ -- 0,372 -- 0,602
C3 0,602 -- 0,372 -- 0,372 1 0,602
C4 0,372 -- 0,602 0,602 -- 0,372
Tableau 3. (2E,4E)--hexa--Z,4-diène C
--0,313
0,253
0,582
0,073 0,582
0,238 0,253 \
\ C, \ 0,616 \ 0,662 \ --0,313 \
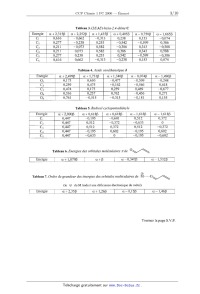
Tableau 4. Acide ox0éthanoïque J
a+1,34OB a--0,074B \ a--1,496B \
-- 0,477 -- 0,509 \ -- 0,248
--O,162 --0,546 \ 0,618
0,259 0,469 \ --0,677 \
0,762 --0,436 \ 0,271 \
--0,315 --0,181 \ 0,155 \
Tableau 5. Radical cyclopentadiényle
\ Energie \ a+2,000B \ 0c+0,618B a+0,618\3 \ a--1,618B \ a--1,618B \
\ C1 \ 0,447 \ --0,195 --0,601 \ 0,512 \ 0,372 \
C2 \ 0,447 \ 0,512 \ --0,372 \ --0,633 \ 0 \
C3 \ 0,447 0,512 \ 0,372 \ 0,512 \ --0,372
C4 0,447 --0,195 0,602 --0,195 0,602
C5 0,447 -- 0,633 0 -- 0,195 -- 0,602
Tableau 6. Energies des orbitales moléculaires 7TdEUR OV\\
Energie a+1,879\3 \ a+B \ 0c--0,347B \ oc--1,SBZB
@
Tableau 7. Ordre de grandeur des energies des orbitales moleculazres de M----OV\
(le @ du M traduit une déficience électronique du métal)
Energie \ a+2,35[3 \ a+1,260 \ a--0,150 \ 0i--1,46B
Tournez la page S.V.P.
A - Réactions avec l'anhydride maléïgue
1 -On désire comparer la réactivité de l'anhydride maléique A avec :
O 1
3 2
| o 7
4 5 ,
! compose A
0 6
- d'une part le butadiène 5 << cis » B, - d'autre part le (2E,4E)-hexa-2,4-diène C. 1.1 -- Donner le nombre d'électrons Tt des molécules A, B et C. On tiendra compte du fait que le substituant méthyle se comporte comme un hétéroatome à deux électrons. 1.2 - A l'aide des orbitales moléculaires obtenues par un calcul de Hückel et données précédemment pour B et C, identifier le diène le plus réactif vis à vis de A. Ce résultat était-il prévisible '? 2 -Lors de la réaction entre le (2E,4E)-hexa-2,4--dién--l--ol et A, il se forme le composé D, qui, par un réarrangement moléculaire, conduit à E. D et E sont isomères de fonctions. Pour ce dernier composé E, on observe en infrarouge deux bandes fortes à 1766 et 1728 cm"1 (l'une de ces bandes correspond à une fonction chimique qui réagit avec le carbonate de sodium en donnant un dégagement gazeux) et une bande faible à 1693 cm'1. Il existe d'autres zones d'absorption non décrites ici. 2.1 - Donner la structure de l'intermédiaire D. Indiquer clairement sa stéréochimie. 2.2 - Identifier le produit E et proposer un mécanisme réactionnel pour le passage de D à E. B - Réactions avec le cyclopentadiène Le cyclopentadiène est largement utilisé dans les réactions de Diels-Alder. En première approximation, on le modélise par le butadiène s « cis >> pour le calcul de
Hückel de ses orbitales
moléculaires.
1 --Le cyclopentadiène n'apparaît pas en tant que tel dans les catalogues de
produits
chimiques. Sa forme commerciale est un hydrocarbure F, de masse molaire 132
g.mol"l, qui
contient 91 % en masse de carbone.
1.1 - Déterminer la formule brute de F. La comparer à celle du cyclopentadiène.
Equilibrer l'équation de la réaction référencée (I.B.l), qui, partant du
cyclopentadiène,
conduit au composé F.
1.2 - Interpréter la transformation envisagée dans la réaction (I.B.l).
2 --Une distillation contrôlée du composé commercial permet de produire le
cyclopentadiène.
A 25 °C, le temps de demi-réaction de la réaction (I.B.1) est d'environ 12
heures en partant du
cyclopentadiène pur. Les réactions étudiées par la suite se déroulant sur une
durée nettement plus
faible, on négligera donc la réaction (I.B.1), car on opère avec du
cyclopentadiène fraîchement
régénéré.
Le cyclopentadiène réagit avec le propénoate de méthyle G (acry1ate de méthyle)
pour
conduire au composé H.
2.1 - Donner une représentation de H en écriture topologique.
2.2 - Cette réaction est catalysée par le tétrachlorure de titane TiCl4.
A partir des données, justifier le rôle catalytique de TiCl4 en admettant un
contrôle
orbitalaire.
Remarque : Pour ce type de réaction, TiCl4 a un comportement identique à celui
de AlCl3.
3 --Le cyclopentadiène réagit avec l'acide oxoéthanoïque J (acide glyoxy1ique)
0
|
5
3 OH
composé J
04
l
2
pour conduire à un composé K qui évolue rapidement vers un autre produit non
considéré ici.
3.1 -- Donner une représentation de K en écriture topologique.
3.2 - En admettant un contrôle orbitalaire, interpréter la régiosélectivité de
la réaction
donnant K.
C - Radical cyclogentadiény1e C5Hg
1 --Combien d'électrons n possède ce radical ?
2 -A l'aide d'un diagramme énergétique et en précisant les valeurs des
énergies, donner la
distribution électronique la plus stable.
3 -- Calculer l'énergie du système TC du radical cyclopentadiény1e.
@
D - Anion cyclopentadiény1e C5H5
1 --Calculer l'énergie du système n de cet anion.
Dans les complexes organométalliques, le radical cyclopentadiény1e a tendance à
prendre un
électron au métal. Interpréter.
2 --Comparer l'énergie du système n de l'anion cyclopentadiény1e à celle d'une
molécule
ayant le même nombre d'électrons TC mais non délocalisés, c'est à dire
assimilable à la superposition
du nombre adéquat de molécules d'éth'ene. L'expression du niveau énergétique
des orbitales
moléculaires TI et 1t* de l'éthène est supposée connue.
Tournez la page S.V.P.'
3 -Donner les structures de Lewis permettant de décrire cet anion et montrer
qu'il est
aromatique.
E - Applications au ferrocène
En 1951, a été découvert le premier métallocène ou complexe sandwich : le
ferrocène L de
formule Fe(C5H5)2. Il s'agit d'un composé organométallique, de couleur orange,
dont le point de
fusion est de 173 °C.
6
.@ composé L
1 -La stoechiométrie du ferrocène peut s'interpréter à l'aide de la règle des
18 électrons.
Combien d'électrons le ligand cyclopentadiény1e donne-t-il au complexe ?
__'fi_
2 -Le ferrocène peut donner des réactions analogues à celles du benzène.
2.1 - On réalise la monoacylation du ferrocène par le chlorure d'éthanoer en
présence de
chlorure d'aluminium AlC13.
2.1.1 -- Ecrire l'équation--bilan de cette réaction.
2.1.2 - Donner le mécanisme de la réaction analogue avec le benzène.
2.2 -- Lorsqu'une deuxième acylation est ensuite réalisée, la substitution a
lieu de manière
très prépondérante sur le cycle non substitué, plutôt que sur le cycle
substitué. Proposer
une interprétation.
2.3 -- Afin d'obtenir le composé M, on réalise les diverses synthèses suivantes
:
,,0
\ GHz--C
CH2 \
F:e / F:e OEt
.--CH2
composé M composé N
2.3.1 - Le ferrocène L, traité par EtOOC--CHz--COCI en présence de A1Cl3,
conduit au
composé N.
Commenter et interpréter la différence de réactivité entre la fonction ester et
la fonction
chlorure d'acer du composé EtOOC--CHZ--COCI.
2.3.2 -- Le groupe carbonyle de N est réduit sélectivement en CH2 puis la
fonction ester
est hydrolysée en milieu basique. Après acidification, on obtient P. Ecrire la
formule
semi--développée de P. Donner le mécanisme de l'hydrolyse.
2.3.3 -- Le composé P est ensuite transformé en chlorure d'acyle Q. Proposer un
réactif
pour cette réaction et écrire la formule semi--développée de Q.
2.3.4 -- Comment peut--on obtenir M à partir de Q ?
2.3.5 - Le ferrocène L réagit avec EtOOC--(CHù--COCI pour conduire au composé
N'.
Ce dernier composé, traité selon les réactions précédemment décrites, donne en
outre un
dérivé homo substitué M'. Ecrire la formule semi--développée de M'.
3 --A l'état solide, la disposition relative des deux cycles cyclopentadiényles
est celle indiquée
sur les différentes figures de la page précédente. Certains dérivés
disubstitués, comme par exemple
F e(C5H4COOH)Z, ont leurs deux cycles éclipsés. Proposer une interprétation.
4 - La chimie organométallique joue un rôle déterminant dans différentes
disciplines
médicales. On utilise désormais des dérivés organométalliques comme marqueurs
de molécules
biologiques en remplacement des traceurs radioactifs ou enzymatiques. Ces
marqueurs sont
constitués d'un fragment organométallique et d'un groupe fonctionnel
susceptible de réagir avec une
molécule nommée "antigène" ou "haptène".
4.1 - Proposer une méthode de synthèse de l'acide ferrocènecarboxylique R
utilisant le
passage par un dérivé lithié. Cet acide sera noté [Ferrocène]-COOH.
4.2 -- La réaction de l'acide ferrocène carboxylique R sur le
N-hydrosuccinimide conduit
au composé S.
Ecrire la formule semi-développée du N-hydrosuccinimide.
Ecrire l'équation--bilan de cette réaction.
Cette réaction s'opère en présence d'un activant, le
1,3--dicyclohexylcarbodiimide (DCG).
Justifier l'intervention de cet activant qui sert à éliminer l'eau. En réalité,
le mécanisme de
la réaction fait intervenir l'attaque préalable de l'acide R par le DCC.
Proposer un
mécanisme réactionnel possible pour l'obtention du composé S.
Col--Il1_I\I=C=Ï\I_CÔI{11 [Ferrocène] -- C02--N '
] , 3 --dicyclohexylcarbodiimide %
O
composé S
4.3 -- Le couplage entre un marqueur organométallique et un "haptène" porteur
d'une
fonction amine --NRR' permet d'obtenir une molécule du type
[Ferrocène]-CO--haptène.
Ce couplage peut être réalisé en utilisant soit le composé S, soit le chlorure
de ferrocényle
T préparé à partir de l'acide R.
Ecrire les équations--bilan des deux réactions engageant ces deux
organométalliques S et T
et préciser dans chaque cas les particularités réactionnelles.
Tournez la page S.V.P.
PARTIE II
Ammoniac et ammoniaque
Données
° Les gaz seront considérés comme des gaz parfaits
Constante des gaz parfaits : R = 8,314 J.K*l.mol--1
° Données thermodynamiques à 298 K
Pour N;(g) : S° = 191,6 J.K--1.mol--l ; cg = 29,1 J.K--1.mor1
Pour H2(g) : S° = 130,6 J.K"1.mol_1 ; CË = 28,8 J.K_1.mol_1
Pour NH3(g) : AfH° = -- 46,21 kJ.mol--1 ; ° = 192,6 J.K--1.morl ; C3 = 35,1
J.K--1.morl
On admettra que les capacités calorifiques molaires sous pression constante ne
dépendent pas de la
température dans l'intervalle envisagé.
° Température d'ébullition de NH3 sous une pression de 1,013 bar : -- 33 °C
° Température d'ébullition de HZO sous une pression de 1,013 bar : 100 °C.
A - Ammoniac
Le diazote, le dihydrogène et l'ammoniac peuvent donner lieu à l'équilibre en
phase gazeuse
ci-après qui représente la réaction de synthèse de l'ammoniac :
Nz(g) + 3 Hz(g) = 2 NH3(g) (II-AJ)
1 --On considère un système constitué de deux sous--systèmes (I) et (Il)
contenant chacun du
diazote, du dihydrogène et de l'ammoniac en présence d'un catalyseur, à une
température T et sous
une pression P.
1.1 -- Ecrire les conditions d'équilibre pour chacun des sous-systèmes (I) et
(II).
1.2 -- En supposant que les deux sous-systèmes sont séparés par une membrane de
Pd
splitéable uniquement au dihydrogène, écrire les conditions d'équilibre :
- pour chacun des sous--systèmes séparés ;
-- pour le système global.
1.3 -- Si on remplace la membrane de Pd par une membrane splitéable à deux des
constituants, que deviendront les conditions d'équilibre envisagées
précédemment ?
2 --La synthèse de l'ammoniac est effectuée à partir des réactifs, NZ et H2,
purs. Pourquoi ne
peut-on pas remplacer NZ par de l'air, pourtant constitué en majeure partie de
N2, pour réaliser la
synthèse de NH3 ?
3 --Déterminer, pour l'équilibre (II.A.1) envisagé, la valeur numérique à 298 K
de la constante
d'équilibre Ko (298 K). Que peut-on déduire de cette valeur de Ko (298 K) '?
4 --Montrer qu'à T et P données, la fraction molaire de NH3 est maximale si
dans le mélange
des réactifs N2 et H2, ces deux gaz sont introduits en proportions
stoechiométriques.
5 _
5.1 - Montrer que l'enthalpie standard de la réaction à une température T est
une fonction
affine de T. Déterminer les constantes de cette fonction A,H° (T) = f(T).
5.2 -- Montrer qu'on peut exprimer la constante d'équilibre par une relation de
la forme :
ln K°(T) = AT--1 + B lnT + C
où A, B et C sont des constantes dont on déterminera la valeur.
Calculer K° (700 K) à 700 K puis l'enthalpie libre standard A,.G° de la
réaction à 700 K.
6 --A partir d'un mélange initial d'une mole de N2 et trois moles de Hz, on
définit
l'avancement de la réaction, E_,, par la différence entre le nombre de moles de
diazote introduit et le
nombre de moles de diazote à un instant donné.
6.1 -- Trouver l'expression numérique donnant AG (700 K) en fonction de 'c'_.,
à 700 K sous
une pression totale P exprimée en bar.
6.2 - Déterminer l'avancement à l'équilibre ëeq :
6.2.1 - pour P = 1 bar,
6.2.2 - pour P = 300 bar.
7 --En fait, la synthèse industrielle de l'ammoniac est réalisée à une
température de l'ordre de
700 K, sous une pression de 300 bar et en présence d'un catalyseur. Justifier
le choix de ces
paramètres.
8 -
8.1 -- Lorsque l'équilibre est réalisé à partir d'un mélange initial d'une mole
de N2 et trois
moles de Hz à une température de 700 K et sous une pression de 300 bar, on
ajoute, à
volume constant, une quantité finie d'argon. Comment évolue le système ?
Justifier votre
réponse.
8.2 - Montrer comment évoluerait le système si, dans les conditions d'équilibre
envisagées
dans la question 8.1, l'argon était ajouté à pression constante ?
8.3 -- A un équilibre entre NZ, H2 et NH3 réalisé à une température T, dans un
volume V et
sous une pression totale P, on ajoute du diazote à la pression P, de telle
sorte que le volume
soit doublé.
Discuter du sens de déplacement de l'équilibre suivant les valeurs de xNz,
fraction molaire
en diazote avant l'ajout.
Que se passerait--il dans le cas de l'équilibre envisagé dans la question 6.2.2
?
B -- Ammoniague
Les solutions aqueuses de NH3 commerciales sont appelées "ammoniaque".
Malgré la solubilité très importante (de l'ordre de 50 mol.L") de l'ammoniac
dans l'eau, le
système HZO -- NH3 ne constitue pas un mélange idéal.
Tournez la page S.V.P.
Les équilibres qui interviennent lors de la dissolution de NH3 dans l'eau sont :
NH3 + HZO : NHZ + OH" pKA = 9,3 à 298 K
2H2 :" H3O+ + OH" pKe=l4à298 K.
1 --Qu'obtiendra-t-on par ébullition des solutions commerciales d'ammoniaque ?
2 -- On envisage le dosage d'une solution d'ammoniaque par un acide fort.
Pour cela on dose V1 = 20 mL d'une solution d'ammoniaque à C1 = 0,10 mol.L--1
par une
solution d'acide chlorhydrique à C2 = 0,20 mol.Lf'.
2.1 -- Déterminer le volume Veq d'acide versé à l'équivalence.
2.2 -- En définissant x par le rapport \72/Veq où V2 est le volume d'acide
versé, donner les
expressions de pH = f(x) pour 0