Mines Physique 1 MP 2002
| Thème de l'épreuve | Transition de phase et évolution vers un état stationnaire hors équilibre |
| Principaux outils utilisés | changements d'état, dérivations partielles et principes thermodynamiques, loi du corps noir, transferts conducto-convectifs |
| Mots clefs | équation de Van der Waals, point critique |
Corrigé
: 👈 gratuite pour tous les corrigés si tu crées un compte👈 l'accès aux indications de tous les corrigés ne coûte que 5 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)



Rapport du jury
(télécharger le PDF)

Énoncé obtenu par reconnaissance optique des caractères
J . 2067
ÉCOLE NATIONALE DES PONTS ET CHAUSSÉES,
ÉCOLES NATIONALES SUPÉRIEURES DE L'AÉRONAUTIQUE ET DE L'ESPACE,
DE TECHNIQUES AVANCÉES, DES TELECOMMUNICATIONS,
DES MINES DE PARIS, DES MINES DE SAINT-ETIENNE, DES MINES DE NANCY,
DES TÉLÉCOMMUNICATIONS DE BRETAGNE,
ÉCOLE POLYTECHNIQUE (FILIÈRE TSI)
CONCOURS D'ADMISSION 2002
PREMIÈRE ÉPREUVE DE PHYSIQUE
Filière MP
(Durée de l'épreuve : 3 heures ; l'usage de la calculatrice est autorisé)
Sujet mis à disposition des concours : Cycle international, ENSTIM, INT,
TPE-EIVP
Les candidats sont priés de mentionner de façon apparente sur la première page
de la copie :
Physique 1 -- Filière MP
L'énoncé de cette épreuve, particulière aux candidats de la filière MP,
comporte 7 pages.
0 Si, au cours de l'épreuve, un candidat repère ce qui lui semble être une
erreur d'énoncé, il le
signale sur sa copie et poursuit sa composition en expliquant les raisons des
initiatives qu'il est amené
à prendre.
0 Tout résultat fourni dans l'énoncé peut être utilisé pour les questions
ultérieures, même s'il n'a
pas été démontré.
o Il ne faudra pas hésiter à formuler tout commentaire qui semblera pertinent,
même lorsque
l'énoncé ne le demande pas explicitement. Le barème tiendra compte de ces
initiatives ainsi que des
qualités de rédaction de la copie.
ASPECTS DES TRAN SITION S
Les deux parties proposées dans cette épreuve sont indépendantes. La première
partie étudie
l'équilibre d'un fluide décrit par l'équation de Van der Waals et la transition
d'état liquide-vapeur. La
seconde partie de l'épreuve traite de l'évolution d'un système thermodynamique
vers un état station-
naire de non-équilibre.
I - Forces et limites de l'équation d'état de Van der Waals.
À la différence de l'équation d'état des gaz parfaits, cette équation rend
compte des transitions de
phase liquide--vapeur et de l'existence d'un point critique. Elle permet aussi
de modéliser l'existence de
retards aux changements d'état. Néanmoins, et particulièrement au voisinage du
point critique, il sub-
siste des écarts notables entre ses prévisions et l'expérience.
I-A L'équation de Van der Waals et les mesures au voisinage du point critique.
L'équation de Van der Waals relie la pression P, le volume V et la température
T d'un
fluide en introduisant deux constantes a et b, positives et caractéristiques de
ce fluide ; pour
une mole, et en notant R la constante des gaz parfaits :
{P+%](V--b)= RT. ...
Page 1/7 Tournez la page S.V.P.
Physique I -- Filière MP - 2002
Cl 1 --- Etablir l'équation de Van der Waals pour n moles de fluide en
utilisant des consi-
dérations sur le caractère intensif ou extensif des variables. Dans la suite,
on raisonnera sur
une mole de fluide.
E] 2 -- La constante b, nommée covolume, représente l'effet de la répulsion à
courte
distance entre deux molécules. Dans le cas de molécules de faible atomicité,
donner un ordre
de grandeur numérique raisonnable pour [) en vous appuyant sur un modèle simple.
' l'...-. D 3-- La figure ci- contre représente, en unités réduites,
l'énergie d'interaction Wentre deux molécules, en fonc--
. ======= tion de la distance r séparant leurs centres de masse. À
l'.ZÉÎ-
' "A....
1.2 1.4 1.6 1.8 2
E] 4 ---- Quel effet représente la constante a ? Comment
justifier le signe positif de a '? Comment interpréter le fait que le terme
correctif de la pres-
sion (la référence étant le gaz parfait) soit une fonction décroissante du
volume '?
. --6
grande d1stance, W oc r . Commenter cette figure ; sau-
riez-vous nommer, voire décrire l'origine physique de
l'interaction à grande distance '? à très courte distance '?
Cl 5 --L'isotherme critique est celle qui possède dans le diagramme (P, V) un
point
critique, point d'inflexion de pente nulle. Déterminer en fonction des
constantes a, b et R les
coordonnées Pc, VC et TC du point critique C. Justifier le fait que Van der
Waals ait pu prévoir
les coordonnées du point critique de l'hélium (T c = 5,2 K, Pc = 2,275 >< 105 Pa) en 1873, bien avant que la technique ne permette d'atteindre de telles températures. Aurait--il été légitime d'exiger a priori la relation HVC = RTC '? --l--l----_---- Ü 6--Commenter le diagramme'ci- contre, représentant trois isothermes du fluide décrit par l'équation [l] pour les 0.5 k _ l'E/î: ' ' températures ]; > TL, 7£ : 71 et ]g < 71 0 'V ""'-- :\ La courbe en pointillés est le lieu des . ,(âP] po1nts ou -- = 0_ av, 1. 5 analogue l'allure des isothermes pour un fluide réel quand il ne se produit aucun retard au changement d'état. Faire figurer sur ce dernier diagramme la courbe de saturation. P V Cl 8 -- Quel est le facteur de compressibilité critiquez C-- '" RT prévu par l'équation de Van der Waals ? On mesure en fait des coefficients z, compris entre 0,29 et 0,31. . 4 , . P V T , . D 9 -- Les var1ables redu1tes pr : î , v, = 7 et 9, : "];-- permettent la representat1on C C C de tous les « fluides de Van der Waals >> par une équation unique, qui s'écrit :
a9, l'
pÏ=flvr--l v2'
'"
Déterminer les valeurs de a, B et 7 (on trouvera que ce sont des nombres
entiers).
Page 2/7
Physique I -- Filière MP - 2002
CI 10 ---- Soient p la masse volumique du fluide et pc sa valeur au point
critique. Intro-
p--p. P--P.
t *:
p.. e p P..
tique ô, défini par la propriété suivante, que l'on établira :
duisant les écarts réduits p* = , trouver la valeur de l'exposant cri--
. . ô '
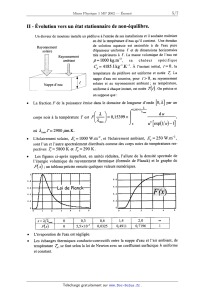
sur l'150therme cr1t1que, pour | p*l << 1, p* : DI p*l , ou D est une constante. Cl 11 ---- La valeur expérimentale de 5 est ôexp : 4,80i 0,02 ; en quoi la différence 5 EUR xp ---- 5l ren seigne-t--elle sur le modèle de Van der Waals ? Cl 12 -- Proposer un dispositif expérimental permettant de faire passer un échantillon de fluide par un état très voisin du point critique. Quel phénomène optique permet de repérer le passage par le point critique '? Quelle en est l'origine '? I-B Énergie interne, capacité calorifique molaire à volume constant et entropie d'un gaz de Van der Waals. Dans cette section, nous nous proposons de comparer un gaz de Van der Waals au gaz parfait associé. L'énergie interne est notée U et l'entropie S. Cl 13 -- À partir de l'expression différentielle du deuxième principe de la thermodyna- mique, établir l'équation de Helmholtz ci--dessous pour un fluide divariant : gg _T2 a(P/T) aV , ar V Cl 14 -- En déduire, sous forme d'une intégrale portant sur le volume, la différence entre l'énergie interne d'une mole de fluide et l'énergie interne d'une mole de gaz parfait pris tous deux à la température T et dans le volume V. Cl 15 -- Comment s'exprime cette différence dans le cas du gaz de Van der Waals '? Cl 16 -- Quel est le comportement d'un gaz de Van der Waals dans une détente de Joule- Gay--Lussac ? Cl 17 -- Comparer les capacités calorifiques molaires à volume constant des deux gaz. Cl 18 ---- En considérant la différentielle de l'énergie libre F = U -- 7ÎS' , montrer que la différence des énergies libres molaires du gaz de Van der Waals (VdW) et du gaz parfait (GP) s'écrit F...(T, V) -- FGP (T, V) =-% -- RT1n(V; b). Exprimer, dans la représentation (T , V) , l'équation d'une adiabatique réversible pour une mole de gaz de Van der Waals. I-C Isothermes pour T < T 6, états instables, états métastables et courbe spinodale. On se propose d'établir le théorème de Maxwell qui permet de remplacer l'isotherme déduite de l'équation de Van der Waals par une isotherme présentant un palier de changement d'état. Il s'agit d'abord de trouver la pression à laquelle est observé le changement d'état à la température T, avec T < T'. On discutera ensuite de la signification des portions de l'isotherme initiale qui ont disparu. Page 3/7 Tournez la page S.V.P. Physique 1 -- Filière MP - 2002 Cl 19 -- En se référant au diagramme ci-dessous, donner sans démonstration la relation liant les potentiels chimiques molaires (notés #) des deux phases : liquide au point A et vapeur au point B. Établir la relation entre les aires hachurée de ce diagramme (ce résultat constitue le théorème de Maxwell). On pourra, par exemple, partir de l'expression de la dif-- férentielle du potentiel chimique molaire dans la représentation (T,P) pour des grandeurs molaires : d ,u = --sd T + vd P , ou encore exprimer directement L P dv C uu.æs Il "JWÏIIE. . l'üêflj' --\\'. 0.75 1 1.25 1.5 1.75 2 2.25 2.5 Cl 20 -- On admet que les états décrits par l'équation de Van der Waals et correspondant à une valeur négative du coefficient de compressibilité isotherme sont des états thermody- namiquement instables. Où ces états sont-ils représentés sur l'isotherme dessinée plus haut '? E] 21 -- Quelle est l'équation P= g(V) de la courbe dite spinodale, située sous la courbe de saturation, qui sépare les états instables des autres états '? EI22-- Pour l'eau a= 0,545 m6Pa. mol _2 et I): 3, OSX 10"5 m3 .mo.l_1 Jusqu'à quelle pression maximale, exprimée en atmosphères, peut-on espérer comprimer de l'eau vapeur à T- --- 1000 C sans observer la formation de gouttes liquides (on prendra R= 8,31 J. K ) '? E] 23 ---- Sous pression assez faible, loin des conditions de liquéfa'ction et dans un domaine limité de température, on peut donner à la relation P = f(V) d'une mole de gaz réel la forme, dite du Viriel : Équation du Viriel Gaz deVan der Waals A(T ) B(T ) .. _ - Gazparfait PV=RT l+_--+ +... . V V2 0 2 4 6 8 10 12 Indiquer, sans développer le calcul, sous quelle condition la relation approchée 27 1 1 prvr : 8? l+%(l-- 89): + 2 est valide pour le gaz de Van der Waals. % Commenter cette relation (sens, ordres de grandeur...). ,. Fin de cette partie Page 4/7 Physique 1 -- Filière MP - 2002 Il - Évolution vers un état stationnaire de non-équilibre. Un éleveur de moutons installe un pédiluve à l'entrée de ses installations et il souhaite maîtriser en été la température d'eau qu'il contient. Une étendue Rayonnement de solution aqueuse est assimilée à de l'eau pure solaire d'épaisseur uniforme EUR et de dimensions horizontales ------- Rayonnement très supérieures à EUR . La masse volumique de l'eau est ambiant p=1000 kg.m_3, sa chaleur spécifique q, = 4185 J .kg_l.K'l. À l'instant initial, := 0, la température du pédiluve est uniforme et notée ]} La nappe d'eau est soumise, pour t > 0, au rayonnement
solaire et au rayonnement ambiant; sa température,
Nappe d'eau
uniforme à chaque instant, est notée Ï(l'). On précise et
on suppose que I
0 La fraction F de la puissance émise dans le domaine de longueur d'onde [0,11]
par un
a
À'max
): 0,15399x ------'-1--"------,
u5 [exp(l/ u) -- l]
0,2014l
Â
Â
max
corps noir à la température T est F{
où ÀmaxÎ= 2900 um.K.
. L'éclairement solaire, E} = 1000 W.m"2, et l'éclairement ambiant, E" = 250
W.m"2
sont l'un et l'autre spectralement distribués comme des corps noirs de
températures res-
pectives 7}: 5800 K et 7; = 290 K.
0 Les figures ci-après rappellent, en unités réduites, l'allure de la densité
spectrale de
l'énergie volumique du rayonnement thermique (formule de Planck) et le graphe de
f(x) ; un tableau précise ensuite quelques valeurs numériques.
_ MM....
. ::.-" Loi de Planck
num...
0.
O.
O.
O.
-u--m----_
___--___--
- L'évaporation de l'eau est négligée.
. Les échanges thermiques conducto-convectifs entre la nappe d'eau et l'air
ambiant, de
température 7;, se font selon la loi de Newton avec un coefficient surfacique h
uniforme
et constant.
Page 5/7 Tournez la page S.V.P.
Physique 1-- Filière MP - 2002
o La nappe d'eau rayonne de façon isotrope.
- Dans le domaine spectral concerné, on néglige toute réflexion sur la nappe
d'eau.
2-A Absorption du rayonnement solaire et du rayonnement ambiant par l'eau.
L'indice complexe de l'eau, noté "* = n + jK (j2= --l), rend compte
simultanément du
déphasage et de l'atténuation d'une onde se propageant dans le milieu (n est
l'indice Optique
27rc
habituel). Le champ électrique d'une onde monochromatique plane de pulsation w
= ----
).
se propageant dans la direction des x croissants vers le bas (l'incidence est
normale) s'écrit
cox Kw
ainsi E: ÆBexp(jn )exp[-- x]exp(--jæl), où c est la célérité de la lumière.
6 c
L'intensité de l'onde, proportionnelle au carré de la norme du champ, s'écrit
/(x) = [(Q) exp(-- ZË:Ù--x] = ](0) exp(--ax) , ce qui définit le coefficient
d'absorption a.
Cl 24 -- Le tableau ci-contre fournit quelques
valeurs numériques. Vérifier numériquement la
validité de la relation entre K et oc
E] 25 -- Exprimer, en fonction de 06 et de EUR , la
fraction q(À,Ê) de l'intensité du rayonne-
ment de longueur d'onde À absorbé par la
nappe d'eau d'épaisseur EUR.
EI 26--Pour une nappe d'eau de 10 cm
d'épaisseur, une documentation commerciale
propose les données figurant dans le dia-
gramme ci-contre. Noter les fenêtres de
- transparence (flèches) pour 0,3< Â < 0,7 O' et À >1. En utilisant ce diagramme et les
indications données plus haut sur le corps noir, calculer numériquement la
fraction du
rayonnement solaire total absorbé, noté Q_(10). Calculer également la fraction
Qa(10) du
rayonnement ambiant total absorbé.
Cl 27 -- Exprimer le lien entre Q(10) et Q_(20). Calculer Q(20).
2-B Évolution temporelle de la température de la nappe d'eau.
L'éleveur choisit le matériau constituant le fond du pédiluve. Il calcule
l'instant tl où la
température du pédiluve d'épaisseur EUR = 10 cm et de température initiale 7; =
17 0C atteint
la température 7} = 25 °C, en distinguant deux hypothèses extrêmes.
1 - Première hypothèse.
La surface SP sur laquelle repose l'eau réfléchit totalement l'intensité de
tout rayonne-
ment dans tout le domaine spectral concerné. Elle est également parfaitement
isolante.
Page 6/7
Physique 1 -- Filière MP -- 2002
Cl 28 -- Quel est dans ce cas le pourcentage de la lumière solaire incidente
absorbé au total
par la nappe d'eau '?
D 29 -- Nommer et décrire les phénomènes dont le système étudié est le siège ;
en déduire le
bilan énergétique de la nappe d'eau. Calculer en kelvins par heure les vitesses
de réchauffe--
ment K(O) et V,,(l'l) pourfi : 10 W.m'Z.K_'. La valeur numérique de la
constante de Ste--
fan est 0 = 5,7 >< 10--8w.m--2.K4'. D 30 -- On néglige le rôle de la convection. Exprimer le bilan énergétique sous la forme : où test une constante de temps que l'on calculera et où T ,. est la température de reférence, dont on donnera la signification physique. D 31 -- Intégrer l'équation de bilan et calculer en heures la valeur numérique de l'instant t,. d u 1 1 On donne : : --arctan(u) + -- ln 1--u4 2 4 1+u +C'e. 1---u Cl 32 -- On conserve maintenant le terme d'échange convectif et on linéarise l'équation obte- nue plus haut. Montrer qu'elle peut se mettre sous la forme : d 7 __ d 1 où T0 et 70 sont des constantes dont on établira l'expression. 70 75--79 Cl 33 -- Calculer [, dans les deux cas suivants : convection faible /z= 10 W.m_Z.K_' et convection forte Æ : 50 W.m--2.K--'. 2 - Seconde hypothèse. La surface S]; est assimilable à un corps noir (totalement absorbant) dont on note 72([) la température. Elle est toujours parfaitement isolante. D 34 -- La vitesse de réchauffement sera--t--elle plus grande ou plus petite que dans le cas précédent '? Justifier votre réponse sans calcul. D 35 -- Écrire l'équation de bilan énergétique de la nappe. Calculer la vitesse de réchauffe- ment initiale V,\,(0) pour h = 10 W.m_2.K_'. E] 36 -- On néglige la convection. Démontrer que l'évolution de la température de la nappe se déduit d'une équation de la même forme que l'équation vue plus haut, mais avec une nou-- velle température de référence dont la valeur numérique n'est pas réaliste. FIN DE CE PROBLÈME FIN DE L'ÉPREUVE Page 7/7