Mines Chimie MP 2010
| Thème de l'épreuve | Le mercure |
| Principaux outils utilisés | atomistique, cristallographie, cinétique, oxydoréduction, diagrammes E-pH, thermochimie |
| Mots clefs | mercure |
Corrigé
: 👈 gratuite pour tous les corrigés si tu crées un compte👈 l'accès aux indications de tous les corrigés ne coûte que 5 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)



Rapport du jury
(télécharger le PDF)

Énoncé obtenu par reconnaissance optique des caractères
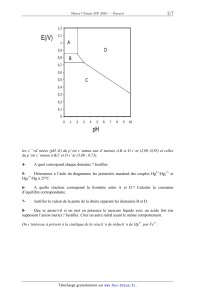
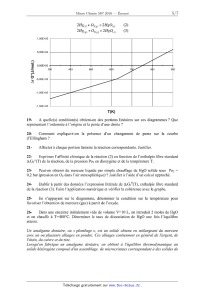
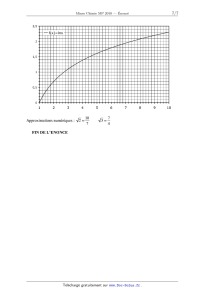
A 2010 Chimie MP ECOLE DES PONTS PARISTECH, SUPAERO (ISAE), ENSTA PARISTECH, TELECOM PARISTECH, MINES PARISTECH, MINES DE SAINT-ETIENNE, MINES DE NANCY, TELECOM BRETAGNE, ENSAE PARISTECH (FILIERE MP) ECOLE POLYTECHNIQUE (FILIERE TSI) CONCOURS D'ADMISSION 2010 EPREUVE DE CHIMIE Filière : MP Durée de l'épreuve : 1 heure 30 minutes L'usage d'ordinateur ou de calculatrice est interdit Sujet mis à la disposition des concours : Cycle International, ENSTIM, TELECOM INT, TPE-EIVP. Les candidats sont priés de mentionner de façon apparente sur la première page de la copie : CHIMIE 2010-Filière MP Cet énoncé comporte 7 pages de texte. Si au cours de l'épreuve, un candidat repère ce qui lui semble être une erreur d'énoncé, il est invité à le signaler sur sa copie et à poursuivre sa composition en expliquant les raisons des initiatives qu'il aura été amené à prendre. DEBUT DE L'ENONCE LE MERCURE Des données utiles pour la résolution du problème sont fournies à la fin de l'énoncé. 1- Parmi les métaux, le mercure possède une propriété particulière. Laquelle ? 2Rappeler les règles générales permettant d'établir la configuration électronique d'un atome dans l'état fondamental et les appliquer à l'atome de mercure. 3- Quels sont les degrés d'oxydation stables du mercure ? Justifier. Nous allons à présent nous intéresser au diagramme potentiel-pH du mercure, représenté cidessous à 25°C avec une concentration totale en mercure en solution de 0,01 mol.L-1, les frontières entre espèces en solution correspondant à l'égalité de leurs concentrations respectives. Les espèces considérées sont Hg(l), HgO(s), Hg2+(aq) et Hg22+(aq). Page 1/7 Tournez la page S.V.P. Chimie 2010 Filière MP les coordonnées (pH ;E) du point commun aux domaines A,B et D sont (2,00 ;0,85) et celles du point commun à B,C et D sont (3,00 ; 0,73). 4- A quoi correspond chaque domaine ? Justifier. 5Déterminer à l'aide du diagramme les potentiels standard des couples Hg2+/Hg22+ et 2+ Hg2 /Hg à 25°C. 6A quelle réaction correspond la frontière entre A et D ? Calculer la constante d'équilibre correspondante. 7- Justifier la valeur de la pente de la droite séparant les domaines B et D. 8Que se passe-t-il si on met en présence le mercure liquide avec un acide fort (en supposant l'anion inerte) ? Justifier. Citer un autre métal ayant le même comportement. On s'intéresse à présent à la cinétique de la réaction de réduction de Hg2+ par Fe2+ : Page 2/ 7 Chimie 2010 Filière MP 2Fe2++2Hg2+ = Hg22++2Fe3+ p q On supposera que la loi de vitesse suit la forme v=k[Fe2+] [Hg2+] On suit la réaction par spectrophotométrie avec différentes concentrations initiales [Fe2+]0 et [Hg2+]0 , on obtient les résultats suivants (le temps est mesuré en unités arbitraires u.a. non précisées) : Expérience n°1 : [Fe2+]0 =0,1 mol.L-1, [Hg2+]0 =0,1 mol.L-1 t(u.a.) 0 [Hg2+]/[Hg2+]0 1 1 2 3 ! 0,50 0,33 0,25 0 Expérience n°2 : [Fe2+]0 =0,1 mol.L-1, [Hg2+]0 =0,001 mol.L-1 t(u.a.) 0 [Hg2+]/[Hg2+]0 1 9- 1 2 4 ! 0,66 0,45 0,20 0 Rappeler en quelques lignes le principe de la spectrophotométrie. 10Expliquer l'intérêt du choix [Fe2+]0=[Hg2+]0 dans la première expérience, et l'intérêt du choix [Fe2+]0>>[Hg2+]0 dans la seconde. 11- Montrer que l'ordre global de la réaction est 2. 12- Montrer qu'on peut raisonnablement estimer que les ordres partiels vérifient p=q=1. Le minerai le plus important pour l'obtention de mercure est le cinabre de formule HgS. Il existe également une variété de même formule, le métacinabre, qui a la même structure que la blende ZnS : les atomes de soufre (en blanc) sont en empilement de type cubique à faces centrées, ceux de mercure (en noir) occupent la moitié des sites tétraédriques. Page 3/7 Tournez la page S.V.P. Chimie 2010 Filière MP 13Donner l'expression du paramètre de maille a du métacinabre en fonction de M(HgS), Na (nombre d'Avogadro) et " (masse volumique). 14Numériquement, on trouve a = 650 pm. Calculer le rayon ionique de Hg2+. Donnée : 2r(S ) = 170 pm A une température supérieure à 580 °C et à la pression atmosphérique, le cinabre se sublime de manière spontanée. On considère l'équilibre : HgS( s ) = HgS( g ) 15- Ecrire la relation entre potentiels chimiques traduisant cet équilibre. 16En déduire l'expression de la pression de sublimation du cinabre en fonction de T et des potentiels chimiques standard. 17Application numérique : donner un ordre de grandeur de la pression de sublimation à 700°C. On prendra µ°(HgS(s)) = -54 kJ.mol-1 et µ°(HgS(g)) = -73 kJ.mol-1 La réaction globale de grillage s'écrit : HgS(g) + O2( g) = Hg(g) + SO2( g) !rG1° (973 K)= -309 kJ.mol-1 (1). 18On considère que le système est composé initialement d'une mole de HgS et d'une certaine quantité d'air amenant une mole de O2. Déterminer l'avancement maximal de la réaction à T=700°C. On prendra p0 = 1 bar. Conclure. Nous allons à présent nous intéresser à la stabilité de l'oxyde HgO(s) qui peut se former lors du grillage. La figure suivante représente les diagrammes d'Ellingham, donnant la variation d'enthalpie libre standard de réaction d'oxydation du mercure par le dioxygène, ramenée à une mole de dioxygène gazeux. Page 4/ 7 Chimie 2010 -- Filière MP 2Hg+ 02 = 2H80 (3) 1,00E+05 5,00E+04 f 0,00E+00 3')0 900 -5,00E+04 Ar G°(Jlmol.) -1,00E+05 -1,50E+05 * WO 19- A quelle(s) condition(s) obtient-on des portions linéaires sur ces diagrammes ? Que représentent l'ordonnée à l'origine et la pente d'une droite ? 20- Comment explique-t-on la présence d'un changement de pente sur la courbe d'Ellingham ? 21- Affecter à chaque portion linéaire la réaction correspondante. Justifier. 22- Exprimer l'affmité chimique de la réaction (2) en fonction de l'enthalpie libre standard AÏG2°(T) de la réaction, de la pression P02 en dioxygène et de la température T. 23- Peut-on obtenir du mercure liquide par simple chauffage de HgO solide sous P02 = 0,2 bar (pression en 02 dans l'air atmosphérique) ? Justifier à l'aide d'un calcul approché. 24- Etablir à partir des données l'expression littérale de ArG3O(T), enthalpie libre standard de la réaction (3). Faire l'application numérique et vérifier la cohérence avec le graphe. 25- En s'appuyant sur le diagramme, déterminer la condition sur la température pour favoriser l'obtention de mercure (gaz) à partir de l'oxyde. 26- Dans une enceinte initialement vide de volume V=10 L, on introduit 2 moles de HgO et on chauffe à T=480°C. Déterminer le taux de dissociation de HgO une fois l'équilibre atteint. Un amalgame dentaire, ou « plombage », est un solide obtenu en mélangeant du mercure avec un ou plusieurs alliages en poudre. Ces alliages contiennent en général de l'argent, de l 'étain, du cuivre et du zinc. Lorsqu'on fabrique un amalgame dentaire, on obtient à l'équilibre thermodynamique un solide hétérogène composé d'un assemblage de microcristaux correspondant a des solides de Page 5/7 Tournez la page S.V.P. Chimie 2010 Filière MP compositions différentes. Nous étudierons dans cette partie la corrosion du plus réducteur de ces solides : Sn8Hg(s) et nous supposerons qu'aucun autre composé présent dans l'amalgame dentaire ne subit de corrosion. C'est pourquoi, nous assimilerons dans toute cette partie un amalgame dentaire à du Sn8Hg(s) pur 27- Ecrire la demi-équation redox correspondant au couple Sn2+/Sn8Hg(s) . En fait, le mercure liquide Hg(l) se combine à Sn8Hg(s) pour donner le solide Sn7Hg(s). 28Ecrire l'équation de cette réaction. Comment doit-on alors écrire la demi-équation redox correspondant au couple Sn2+/Sn8Hg(s), sachant qu'elle ne fait pas apparaître Hg(l)? 29Ecrire l'équation de réduction de l'eau par Sn8Hg(s) et calculer sa constante d'équilibre K(T) à la température du corps humain. On supposera que tous les solides intervenant dans cette équation sont purs. Conclusion? Données : Constante d'Avogadro : NA= 6,0.1023 mol-1. Constante des gaz parfaits :R= 8,3 J.K-1.mol-1 RT Constante de Nernst à 298 K : ln10 = 0,06V F Z(Hg)=80 à 298 K : !fH0(kJ.mol-1) S0(J.K-1.mol-1) Hg(l) 76 Hg(g) 59 170 HgO(s) -91 70 O2(g) 205 Potentiels standard à 310,15 K, pH=7,2 (conditions biologiques) : Sn2+/Sn8Hg(s) E01= -0,13 V H2O (l) /H2 (g) E02= -0,83 V Page 6/ 7 Chimie 2010 -- Filière MP ": 2 "Ill--__!Ëll-l 2,5 --f(x)=lnx 10 10 7 ...-- Approximations numériques : w/Ï FIN DE L'ENONCE Tournez la page S.V.P. Page 7/7