Mines Chimie MP 2006
| Thème de l'épreuve | Le carbone |
| Principaux outils utilisés | atomistique, thermochimie, diagrammes d'Ellingham, cristallographie |
Corrigé
: 👈 gratuite pour tous les corrigés si tu crées un compte👈 l'accès aux indications de tous les corrigés ne coûte que 5 € ⬅ clique ici
👈 gratuite pour tous les corrigés si tu crées un compte
- - - - - - - - - - - - - - - - - - - - - - - - - -
Énoncé complet
(télécharger le PDF)




Rapport du jury
(télécharger le PDF)


Énoncé obtenu par reconnaissance optique des caractères
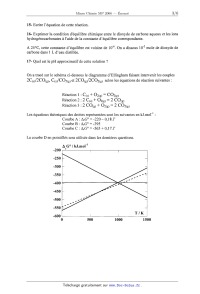
ECOLE NATIONALE DES PONTS ET CHAUSSEES. ECOLES NATIONALES SUPERIEURES DE L'AERONAUTIQUE ET DE L'ESPACE, DES TECHNIQUES AVANCEES, DES TELECOMMUNICATIONS, DES MINES DE PARIS, DES MINES DE SAINT-ETIENNE, DES MINES DE NANCY, DES TELECOMMUNICATIONS DE BRETAGNE. ECOLE POLYTECHNIQUE ( Filière TSI ). CONCOURS D'ADMISSION 2006 EPREUVE DE CHIMIE Filière : MP Durée de l'épreuve : 1 heure 30 minutes L'usage d'ordinateur ou de calculatrice est interdit Sujet mis à la disposition des concours : Cycle International, ENSTIM, TPE--EIVP. Les candidats sont priés de mentionner de façon apparente sur la première page de la copie : CHIMIE 2006- MP Cet énoncé comporte 6 pages de texte. Si au cours de l'épreuve, un candidat repère ce qui lui semble être une erreur d'énoncé, il le signale sur sa copie et poursuit sa composition en expliquant les raisons des initiatives qu'il est amené à prendre. DEBUT DE L'ENONCE LE CARBONE Les données numériques nécessaires à la résolution du problème sont rassemblées à la fin de l'énoncé. I L'élément carbone L'élément carbone a pour numéro atomique Z = 6. 1- Donner la configuration électronique de l'atome de carbone dans son état fondamental. Expliquer pourquoi le carbone est tétravalent. 2- Citer deux isotopes du carbone et donner la structure de leurs noyaux. 3-- Où se situe le carbone dans la classification périodique (ligne, colonne) ? 4- Citer 2 éléments situés dans la même colonne que le carbone. II Structure du carbone solide Le carbone solide existe dans la nature sous deux structures cristallines différentes: le graphite et le diamant. 5- Nommer et décrire brièvement une autre structure (non naturelle) de carbone solide. 6- Représenter la maille cristalline du diamant. 7-- Définir et calculer la coordinence et le nombre d'atomes par maille. 8- Donner la relation liant le paramètre de maille noté a et le rayon r d'un atome de carbone. 9-- En déduire la compacité du diamant (la valeur numérique devra être calculée). 10- Calculer la masse volumique du diamant. 11- Le diamant contient--il des sites permettant d'accueillir des atomes supplémentaires ? Si oui, combien sont-ils et où se situent--ils '? 12- Exprimer la densité du graphite en fonction de la longueur de liaison 11 carbone-carbone dans les feuillets et de la distance 12 entre les feuillets. Sachant que la densité du graphite est proche de 2,3 et que 11=O,142nm, en déduire une valeur approximative de 12. Dans toute la suite de l'énoncé, le carbone solide sera considéré sous forme de graphite. III Les oxydes de carbone Le carbone peut, en présence d'oxygène, former du monoxyde de carbone gazeux ou du dioxyde de carbone gazeux. 13- Ecrire la formule de Lewis pour le dioxyde de carbone. Quelle est la géométrie de cette molécule ? 14- Ecrire la formule de Lewis pour le monoxyde de carbone. La formule est--elle en accord avec les électronégativités du carbone et de l'oxygène ? Justifier. Le dioxyde de carbone gazeux peut se dissoudre dans l'eau suivant l'équation de réaction suivante : CO2 (g) = CÛ2 (aq) Le dioxyde de carbone aqueux peut donner lieu à la formation dans l'eau d'ions hydrogénocarbonates. 15- Ecrire l'équation de cette réaction. 16- Exprimer la condition d'équilibre chimique entre le dioxyde de carbone aqueux et les ions hydrogénocarbonates à l'aide de la constante d'équilibre correspondante. A 25°C, cette constante d'équilibre est voisine de 106. On a dissous 10°2 mole de dioxyde de carbone dans 1 L d'eau distillée. 17-- Quel est le pH approximatif de cette solution '? On a tracé sur le schéma ci-dessous le diagramme d'Ellingham faisant intervenir les couples 2C(s)/2CO(g), C(S)/COz(g) et 2CO(g)/2COz(g) selon les équations de réaction suivantes : Réaction 1 : @@ + 02(g) : CO2(g) Réaction 2 : 2 C(s) + 02(g) : 2 CO(g) Réaction 3 : 2 CO(g) + Û2(g) : 2 C02(g) Les équations théoriques des droites représentées sont les suivantes en kJ.mol'1 : Courbe A : ArG° = --220 -- O,l8.T Courbe B : A,G° = --395 Courbe C : ArG° = -565 + 0,17.T La courbe D en pointillés sera utilisée dans les dernières questions. A G° / kJ.mol" -200 V 0.50 -300 -350 400 450 --500 -550 -600 0 500 1000 1500 18-- Rappeler en quoi consiste l'approximation d'Ellingham. 19-- Attribuer les 3 droites aux 3 couples d'espèces chimiques du carbone. 20-- Montrer que dans certains domaines de température, certaines espèces ne sont pas stables. 21--Représenter alors le diagramme d'Ellingham simplifié pour les espèces C(S), CO(g) et C02- Utilisation du diagramme d 'Ellingham. Dans la nature, l'élément fer se rencontre sous la forme d'oxydes de fer : la wüstite FeO, l'hématite FEUR203, et la magnétite F6304. 22- Quel est le degré d'oxydation de l'élément fer dans ces oxydes ? La courbe D se réfère au couple 2Fe / 2FeO. 23-- Peut-on élaborer du fer à partir de F eO en utilisant du carbone ? 24- Comment appelle-t-on un alliage de fer et de carbone (1% de carbone) '? IV Un exemple de carbure : le carbure de silicium SiC Le carbone réagit avec la plupart des éléments chimiques pour former des composés nommés "carbures". ' Parmi eux, le carbure de silicium est utilisé depuis le XIX"me siècle pour réaliser des poudres abrasives grâce à ses propriétés de dureté ou des céramiques de revêtement pour sa résistance à la température et aux agents chimiques corrosifs. Plus récemment, de nouvelles applications en électronique de puissance se sont fait jour. Ce composé est en grande partie préparé industriellement par carboréduction de la silice, transformation schématisée par l'équation suivante : Sl02(s) + 3 C(S) : SlC(S) + 2 COoe) (I) Le tableau suivant regroupe les valeurs des enthalpies standard de formation et entr0pies standard des espèces intervenant dans l'équation (I) : 25-- Calculer l'enthalpie standard associée à l'équation de carboréduction (1). Quel serait alors l'effet d'une élévation de température sur l'évolution de la composition d'un mélange de .SiOz(s) , C(S) , SiC(S) et CO(g) initialement en équilibre thermodynamique ? Justifier. 26- Calculer l'entropie standard associée à l'équation de carboréduction (I) ? Justifier le signe de cette grandeur. 27-- En déduire pour la transformation de carboréduction l'existence d'une température d'inversion Ti dont on précisera la valeur numérique. Le carbure de silicium a la particularité de présenter de multiples formes cristallographiques appelées "polytypes" (environ 170 polytypes sont répertoriés pour SiC). Si l'on assimile chaque motif SiC à une sphère, il est possible de représenter les polytypes de SiC par des empilements de plans denses de ces sphères de type A, B ou C (notation identique à celle des plans considérés dans le cas des structures compactes). Les polytypes les plus courants sont : @ AB/AB/. .. @ ABC/ABC/. .. @ ABAC/ABAC/... @ ABCACB/ABCACB/... La notation de Ramsdell consiste à représenter un polytype par la notation NX N étant le nombre de plans de la cellule et X étant une lettre désignant la symétrie de l'empilement (C pour cubique, H pour hexagonale). 28-- Nommer les polytypes @ et @ à l'aide de la notation de Ramsdell. A quels types de structure correspondent--ils ? Données numériques : On utilisera les valeurs approximatives suivantes dans le problème : MC = 12 g.mol'1 Nombre d'Avogadro : 6.1023 mol'1 Rayon de l'atome de carbone : r = 8.10"1 m Onposera: "243 -- 0,34 325 = 3,2.104 2,3.../ä =4 FIN DE L'ENON CE